
11.日本的白川英树等于1977年首先合成出带有金属光泽的聚乙炔薄膜,发现它具有导电性。这是世界上第一个导电高分子聚合物。研究研究者为此获得了2000年诺贝尔化学奖。
(1) 写出聚乙炔分子的顺式和反式两种构型。
(2) 若把聚乙炔分子看成一维晶体,指出该晶体的结构基元。
(3) 假设有一种聚乙炔分子头尾连接起来,形成一个大环轮烯分子,请画出该分子的结构。π电子在环上运动的能量可由公式 给出,式中h为普朗克常数(6.26×10-34J·s),me是电子质量(9.109×10-31kg),l是大环周边的长度,量子数0,±1,±2,……。计算电子从基态跃迁到第一激发态需要吸收的光的波长。
给出,式中h为普朗克常数(6.26×10-34J·s),me是电子质量(9.109×10-31kg),l是大环周边的长度,量子数0,±1,±2,……。计算电子从基态跃迁到第一激发态需要吸收的光的波长。
10.(1) O22+是奇特的分子离子,你可以预期它不可能存在的理由是什么?但在六十年代中期在实验上发现了它的存在,其理由又是什么?
(2) O22+分子离子的位能图如下,其形状称为“火山”形
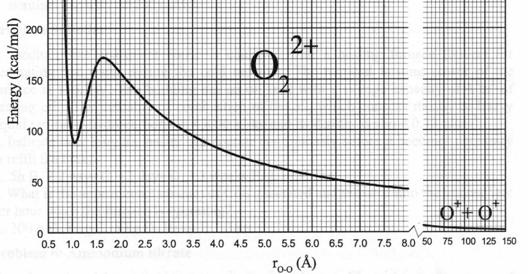
① 为形成O22+分子离子,两个O+离子的最小动能是多少?
② O22+在热力学上稳定吗?在动力学上稳定吗?
③ O22+的离解能是多少?
④ O22+可以用来储存能量,1个O22+ 分子离子可储存能量?
⑤ O+-O+的键长是多少?
⑥ 为形成O22+离子,两个O+阳离子之间应相距的最短距离是多少?
9.氢原子的稳态能量由下式给出:En = -2.18×10-18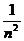 (J),n为主量子数
(J),n为主量子数
(1) 计算 ① 第一激发态(n = 2)和基态(n = 1)之间的能量差,② 第6激发态(n = 7)和基态(n = 1)之间的能量差。
(2) 上述赖曼系(Lyman)跃迁处于什么光谱范围?
(3) 解释:由Lyman系光谱的第1条线及第6条线产生的光子能否使:① 处于基态的另外的氢原子电离? ② 晶体中的铜原子电离?(铜的电子功函数为Φ=7.44×10-19J)
(4) 若由Lyman系光谱的第1条谱线和第6条谱线产生的光子使铜晶体电离,计算这两种情况中从铜晶体发射出的电子的德布罗意波长。
8. 轭多烯烃的π电子可看作自由电子模型。已知(1)丁二烯 (2)维生素A (3)胡萝卜素分别为无色、桔黄色和宝石红色,请定性解释这些化合物的颜色。
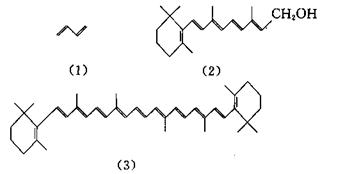
若维生素A在332nm处吸收最强,试估算箱的长度。
7. 由于染料的合成,化学工业在十九世纪经历了一次大发展。当时人们无法理解合成的染料为何有这样鲜艳的颜色。
现今量子力学对此作了解释。某些染料分子可看作一维分子,电子分布在其上,电子的波长应当与分子给定的空间相匹配。这种模型称为“一维势箱理论”。每种波长对应于某一确定的能量。当波长处于可见光区域(400-650nm),分子就显色。
(1) 用图表示电子的三种最长的波长,如何与长度l的“一维”分子相匹配。
(2) 写出作为长度为l的函数的电子的可能波长的一般表达式。
(3) 试写出分子中的电子的可能的能量,它们是长度l的函数。(在一维势箱中,势能为零)
(4)
试推出:对于长度为l的链,有k个电子,发生最长波长的吸收时,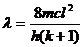 ,其中k为偶数,c为光速,h为普郎克常数。
,其中k为偶数,c为光速,h为普郎克常数。
(5) 试设想有一个由双键构成的共轭体系的线性分子,其中的π电子导致分子显色。每增加一个碳原子时,π电子体系中增加一个电子,分子的长度的增值为a,a为共轭体系中一个C-C键的键长。碳原子数为N,推导N为偶数时,一级电子迁移的波长(即最长波长)对碳原子数的函数表达式。
(6) 再推导N为奇数时,一级电子迁移的波长对碳原子数的函数表达式。
6.
按量子论看,电子具有波粒二象性,其波长 。若电子在半径为r的圆环上运动时,圆的周长必须与电子波半波长的整数倍相合。
。若电子在半径为r的圆环上运动时,圆的周长必须与电子波半波长的整数倍相合。
(1) 今将苯考虑成一个半径为r的圆(r = 0.139nm),试给出苯上π电子运动所表现的波长。
(2)
试证在π轨道上,电子动能
(3) 当n = 0时被认为是能量最低的π轨道,则6个π电子将分别填充在哪些轨道上,它们的n 值各为多少?最低空轨道的n 值是多少?
(4)
紫外光谱是电子在光的作用下从一个轨道跃迁到另一个轨道产生的。试证明苯分子的最低紫外吸收应为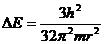 ,并写出计算此跃迁过程的波长。
,并写出计算此跃迁过程的波长。
|
(5) 试问,联苯分子 |
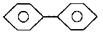 |
的最低能量吸收和苯相比,是向能量最 |
高的方向位移还是向能量低的方向位移?请说明理由。
5. 电离1mol自由铜原子得1mol Cu+,需能量746.2kJ,而由晶体铜电离获得1mol Cu+ 仅消耗434.1kJ能量。
(1) 说明上述两电离过程所需能量不同的主要原因。
(2) 计算电离1 mol晶体铜所需照射光的最大波长。
(3) 升高温度可否大大改变上述两电离过程所需的能量?在高温时,这两种电离能有无差别?
4. 在电势差为100V和1000V的电场中运动运动的电子,其德布罗意波长分别为多少?
3. 氯分子的解离是一个吸热过程,△H =243.6(kJ·mol-1)。光也可以引起氯的解离。问:
(1) 预期引起氯解离的光的波长多少?
(2) 比计算的临界值长或短的波长的光也能引起氯的解离吗?
(3) 临界波长的光子的能量多大?
(4) 当能引起氯解离的光照射氯气和氢气的混合物时,将生成氯化氢。设混合气体受到汞紫外灯(λ=253.6nm)照射,灯的输入功率为10瓦,其中2%的能量被装入10升容器中的混合气体吸收。在受照射2.5秒期间,生成了65mmol(毫摩尔)的氯化氢气体。问量子产额多大?(量子产额 = 每吸收一个光子得到产物分子的个数)
2. 史蒂文·琼斯于1985年成功地在约373K实现低温核聚变,成为举世瞩目的重大新闻。低温核聚变的奥秘在于μ原子的应用。所谓μ原子就是把核外电子换成带一个单位负电荷的μ原子后的氘原子。
(1) 依据玻尔理论,请导出这种μ原子半径r与核外μ原子质量m之间的关系式。
(2) 已知μ原子的静止质量m = 1.884×10-28 (kg),电子的静止质量m = 9.11×10-31 (kg),则μ原子的半径r是氘原子半径r的多少分之一?为什么?
(3) 根据你所掌握的理论,说明为什么氘氘熔合(核聚变)要在亿度高温下才能实现?
(4) 为什么用μ原子就可以实现低温核聚变?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com