
9.过二硫酸根离子是已知最强的氧化剂之一,虽然其氧化反应相对较慢。过二硫酸根离子能氧化除氟离子外的所有卤素离子。
 按S2O82- + 2I― 2SO42- + I2式生成碘的起始速率为r0。在25℃下,测定了以反应物起始浓度(c0)为函数的起始速率如下:
按S2O82- + 2I― 2SO42- + I2式生成碘的起始速率为r0。在25℃下,测定了以反应物起始浓度(c0)为函数的起始速率如下:
|
c0(S2O82-)[ mol·L-1 ] |
c0(I―)[ mol·L-1 ] |
r0(10-8)[ mol·L-1·s-1 ] |
|
0.0001 |
0.010 |
1.1 |
|
0.0002 |
0.010 |
2.2 |
|
0.0003 |
0.005 |
1.1 |
(1) 画出过二硫酸根离子的以短线表达化学键的结构,并给出所有原子的氧化态。
(2) 写出上述反应的速率方程。
(3) 写出上述反应的总级数和各反应物的级数。
(4) 推导出该反应的速率常数为0.011 L· mol-1·s-1。
已知上述反应的活化能为42kJ· mol-1。
(5) 在什么温度(°C)下速率常数将增加10倍?
碘与硫代硫酸根离子(S2O32-)反应生成碘离子是快速的。
(6) 写出该反应的反应式。
 (7) 设溶液中相对于过二硫酸根离子和碘离子存在过量的硫代硫酸根离子,写出反应 S2O82- + 2I― 2SO42- + I2的速率方程。
(7) 设溶液中相对于过二硫酸根离子和碘离子存在过量的硫代硫酸根离子,写出反应 S2O82- + 2I― 2SO42- + I2的速率方程。
8.在300K,鲜牛奶5小时后即变酸,但在275K的冰箱里可保存50小时,牛奶变酸反应的活化能是 。
7.Co-60广泛用于癌症治疗,其半衰期为5.26年,则其衰变速率常数为 ,某医院购得该同位素20mg,10年后剩余 mg。
5.298.2K,反应:A + 2B = 2C + 2D的速率方程为 v = k[A]x[B]y
(1) 当A、B的初始浓度分别为0.010、0.020mol·L-1时,测得反应物B在不同时刻的浓度数据如下:
t / h 0 90 217
[B] / mol·L-1 0.020 0.010 0.0050
求该反应的总反应级数
(2) 当A、B的初始浓度均为0.020 mol×L-1时,测得初始反应速率为实验(1)的1.4倍,求A和B的反应级数x和y。 提示:
(3) 求算反应速率常数k。
|
6.正、逆反应均为一级的对峙反应 |
 |
,A、B分别表示反式或顺 |
式-[Cr(en)2(OH)2]+。k1、k2分别为正、逆向反应的速率常数。实验测得如下数据:
|
反应温度 T / K |
反应时间 t / min |
反应体系中 cA / (mmol·dm-3) |
A、B的浓度 cB / (mmol·dm-3) |
|
298 298 298 308 308 308 |
0 2.2 足够长 0 0.7 足够长 |
1.2 1.2 |
0 0.05 0.15 0 0.05 0.15 |
该体系的速率方程为dcB/dt = k1cA-k-1cB,经推导得公式
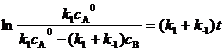 ,cA0为t=0时,体系中A的浓度,cA、cB分别为反应时间t时,体系中A、B的浓度。试解答下列问题:
,cA0为t=0时,体系中A的浓度,cA、cB分别为反应时间t时,体系中A、B的浓度。试解答下列问题:
(1) 当t=0时,体系中仅有A,cA0 = 2.1 mmol·dm-3,实验在某一恒定温度下进行,要求当体系中B的浓度达到 0.10 mmol·dm-3时的反应速率为0.13 mmol·dm-3·min-1,请通过计算(要写出计算过程)确定合适的反应温度是否可在298K-308K范围内选择?
(2)

 已知[Cr(en)2{OH}2]+的Sm (顺式,298K)、Sm (反式,298K),也请(通过计算)确定A、B中哪个是顺式?哪个是反式?
已知[Cr(en)2{OH}2]+的Sm (顺式,298K)、Sm (反式,298K),也请(通过计算)确定A、B中哪个是顺式?哪个是反式?
4.五氧化二氮是晶体,具有很高的蒸汽压,在气相或在惰性溶剂中都能全部分解,产物为氧、二氧化氮和四氧化二氮的混合物。其分解反应为:
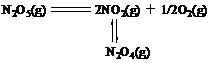
此反应为一级反应。由于分解产物NO2和N2O4均溶于CCl4中,只能有O2逸出,故N2O5在CCl4中的分解可用气量管测定分解产物逸出的O2的体积来测定。下表是0.7372 g固体N2O5在30 0C和p0压力下的实验数据:
时间t (秒) 0 2400 9600 16800
体积V (ml) 0 15.65 45.85 63.00
(ml) 0 15.65 45.85 63.00
(1) 求算此反应的速率常数k及半衰期t1/2;
(2) 30℃,分解90.0%时所需时间为多少秒?
(3) 已知该反应活化能为1.03´105 J·mol-1,若要求2400秒内收集60.00ml O2 (30 0C时的体积),问需在什么条件下进行实验?(气体按理想气体处理,气体常数R=8.314 J·K-1·mol-1)
3.电机在运转过程中的发热,导致所用漆包线表面漆膜发生热降解作用,绝缘性逐渐降低,并最终失效。实验表明:异氰酸酯树脂改性缩醛漆包线在恒温箱中热老化,温度分别为393.0K、111.0K和453.0K,寿命分别为20000h、5000h和307h,此时漆膜重量均减少39.0%;假定热降解机理不变且服从一级反应规律,试推算它在348.0K的正常使用温度下漆包线的寿命有多长?热降解的活化能为多少?
2. 在含有缓冲介质的水溶液中,300K时,研究某无机物A的分解反应:A (l) ® B (g) + H2O (l),假定气态产物B在水中不溶,有以下实验事实:
a. 固定A溶液上部的体积,在不同时间t下,测定产物B气体的分压p, p与t数据满足ln[p¥/(p¥-p)] = k’t方程,式中p¥为时间足够长时,A(l)完全分解所产生的B(g)的分压,k’为一常数。
b. 改变缓冲介质,在不同的pH下进行实验,作lg(t1/2) ~ pH图,可得到一条斜率为-1, 截距为lg (0.693/ k)的直线。k为实验速率常数。
请回答下列问题:
(1) 从上述实验结果出发,试求该反应的实验速率方程。
(2) 有人提出如下机理: 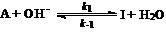
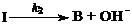
式中k1、k-1分别为响应纪元反应的速率常数,你认为上述反应机理与实验事实是否相符,为什么?
1.超氧化物歧化酶SOD(本题用E为代号)是生命体中的“清道夫”,在它的催化作用下生命体代谢过程产生的超氧离子才致过多积存而毒害细胞:2O2-+
2H+ 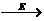 O2
+ H2O2 今在SOD的浓度为c0(E)
= 0.400´10-6mol·L-1, pH = 9.1的缓冲溶液中进行动力学研究,在常温下测得不同超氧离子的浓度c (O2-)下的超氧化物歧化反应的反应速率r如下:
O2
+ H2O2 今在SOD的浓度为c0(E)
= 0.400´10-6mol·L-1, pH = 9.1的缓冲溶液中进行动力学研究,在常温下测得不同超氧离子的浓度c (O2-)下的超氧化物歧化反应的反应速率r如下:
c (O2-)/ mol·L-1 7.69´10-6 3.33´10-5 2.00´10-4
r / mol·L-1·s-1 3.85´10-3 1.67´10-2 0.100
(1) 依据测定数据,确定歧化反应在常温下的速率方程r = k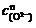 的反应级数
的反应级数
(2) 计算歧化反应的速率常数k, 要求计算过程
(3) 在确定了上述反应的基础上,有人提出了歧化反应的机理如下:
E + O2-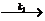 E- + O2
E- + O2
E- + O2-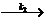 E + O22-
E + O22-
其中E-为中间物,可视为自由基,过氧离子的质子化是速率极快的反应,可以不予讨论。试由上述反应机理,推导出实验得到的速率方程,请明确指出推导过程所作的假设。
15.纳米尺寸的金属簇合物的性质与大颗粒的物质不同。为研究银纳米簇合物的电化学性质,设计了如下原电池(式中右边的半电池的电势较高);
① Ag(S) | AgCl(饱和溶液)|| Ag+ (c = 0.01 mol · L-1) | Ag(S) ε1 = 0.170V
② Pt | Agn(S,纳米簇),Ag+ (c = 0.01 mol · L-1) || AgCl(饱和溶液)| Ag(S)
(a) 对Ag10纳米簇,ε2 = 0.43V (b) 对Ag5纳米簇,ε3 = 1.030V
 (1) 计算AgCl的溶度积。 已知:φ
(1) 计算AgCl的溶度积。 已知:φ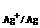 = +0.800V, T =
298.15K
= +0.800V, T =
298.15K
(2) 计算Ag5和Ag10纳米簇的标准电极电势。
(3) 为什么银的电极电势与银的颗粒大小有关?
(4) 将上列原电池作如下改变,将发生什么变化?
(a) 使第二个实验中的Ag10纳米簇和Ag5纳米簇电池的电解质的pH = 13。
(b) 使第二个实验中的Ag10纳米簇和Ag5纳米簇电池的电解质的pH = 5。
(c) 使第二个实验中的Ag10纳米簇和Ag5纳米簇电池的电解质的组成改为pH = 7,c(Cu2+) = 0.001 mol · L-1,c(Ag+) = 1·10-10 mol · L-1。通过计算说明。
反应不断进行,将发生什么变化(定性说明)?
 已知:φ
已知:φ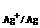 = +0.800 V
= +0.800 V
 φ
φ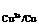 = +0.345 V
= +0.345 V
T= 298.15 K
14.过渡金属碳化物,如TiC,因极硬,极其搞腐蚀、高熔点,广泛用于制造切割工具和磨料等。此外,碳化钛具有高导电性,且几乎与温度无关,在电子工业中是重要的。
(1) 已知半径r (Ti4+) = 74.5,r (C4-) = 141.5pm,TiC晶体可能取哪种结构?
(2) 计算如下式所示的TiC工业生产反应的焓变:
 TiO2 + 3C TiC + 2CO
TiO2 + 3C TiC + 2CO
D fH (TiO2) = - 944.7 kJ·mo-1
D rH (CO) = -110.5 kJ·mo-1
 D.rH (TiC
+ 3/2 O2 TiO2
+ CO) = -870.7 kJ·mo-1
D.rH (TiC
+ 3/2 O2 TiO2
+ CO) = -870.7 kJ·mo-1
(3) 用下列数据构建热力学玻恩-哈伯循环,计算氯化钾的晶格能。
 钾的升华焓 K(s) K(g) D.subH
= 89 kJ·mo-1
钾的升华焓 K(s) K(g) D.subH
= 89 kJ·mo-1
 氯的解离能 Cl2(g) 2Cl D.dissH
= 244 kJ·mo-1
氯的解离能 Cl2(g) 2Cl D.dissH
= 244 kJ·mo-1
 氯的电子亲和势 Cl(g) + e-
Cl-(g) D.EAH
= -355 kJ·mo-1
氯的电子亲和势 Cl(g) + e-
Cl-(g) D.EAH
= -355 kJ·mo-1
 钾的电离能 K(g) K+(g) + e-
D.IEH
= 425 kJ·mo-1
钾的电离能 K(g) K+(g) + e-
D.IEH
= 425 kJ·mo-1
 KCl的生成焓 K(s) + 1/2Cl2(g) KCl(s)
D.fH
= - 438 kJ·mo-1
KCl的生成焓 K(s) + 1/2Cl2(g) KCl(s)
D.fH
= - 438 kJ·mo-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com