
14.金属单晶的结构可用等径圆球的密堆积模拟。常见的最紧密堆积型式
有立方最密堆积和六方密堆积。
(1) 立方最密堆积的晶胞如图一。请用“X”和“Δ”分别标出其中的正四面体空隙和正八面体空隙的中心位置,计算晶体中球数、四面体空隙数和八面体空隙数之比,并计算此种堆积的空间利用率。


(2) 六方密堆积如图二所示。请用“X”和“Δ”分别标出其中的正四面体空隙和正八面体空隙的中心位置,计算此晶体中球数、四面体空隙数和八面体空隙数之比,并计算此种堆积的空间利用率。
(3) 已知离子半径的数据:rTi3+ = 77pm,rCl– = 181pm;在β-TiCl3晶体中,取Cl–六方密堆积的排列,Ti3+则是填隙离子,请回答:Ti3+离子体填入由Cl–离子围起的哪种多面体空隙?它占据该种空隙的百分数为多少(写出推算过程)?它填入空隙的可能方式有几种?
13.C60分子晶体属于NaCl型,根据C60分
子晶体的晶胞图,回答下列问题:
(1) C60分别占据立方体的什么位置?
(2) 在晶胞中C60分子可以围成哪几类空隙?
(3) C60分子数与这些类型空隙数之比(最简单整数比)为多少?
(4) 当碱金属元素全部占满C60晶体中所有空隙,这类C60掺杂物才有超导性。若用金属铯填满后,请写出该掺杂物的化学式。
(5) 室温下,C60晶体的晶胞参数a = 14.20Å(1Å = 10–8cm),计算金属填隙前,C60分子晶体的密度是多少?填满Cs后,该晶体的密度是多少?(Cs的相对原子质量:132.9)
12. 金刚石的立方晶胞如右图所示,晶胞边
金刚石的立方晶胞如右图所示,晶胞边
长a = 356.6pm
(1) 列式计算C-C键长
(2) 列式计算碳原子的空间利用率
(3) 说明金刚石硬度大的原因
11.将一定量的纯粹的NiO晶体在氧气中加热,部分Ni2+被氧化为Ni3+,得到氧化物NixO,测得该氧化物的密度为6.47g·cm–3,已知Ni的相对原子质量为58.70,纯粹的NiO晶体具有NaCl型结构,核间Ni-O的距离为207.85pm,O2–的离子半径为140pm
(1) 画出纯粹的NiO立方晶胞
(2) 计算NixO的晶胞参数
(3) 计算x值,并写出该氧化物的化学式(要求标明Ni元素的价态)
(4) 在NixO的晶体中,O2–采取何种堆积方式?Ni在此堆积中占据哪种
空隙?占据的百分比是多少?
(5) 在NixO的晶体中,Ni-Ni间的最短距离是多少?
(6) 将NixO的晶与NiO晶体比较,Ni和O2–的配位数有何变化(指平均情况)
10. 铜矿是最重要的铜矿,全世界约三分之二的铜是由它提
铜矿是最重要的铜矿,全世界约三分之二的铜是由它提
炼的。
(1) 右图为黄铜矿的晶胞,计算该晶胞中各种原子的数目,写出黄铜矿的化学式
(2) 在黄铜矿的晶胞中,化学和空间环境都相同的硫原子、铁原子、铜原子各有几个?在黄铜矿晶胞中含几个结构基元(周期性重复的最小单位)?每个结构基元代表什么?
(3) 在高温下,黄铜矿晶胞中的金属原子可以发生迁移。若铁原子与铜原子发生完全无序的置换,可将它们视为等同的金属原子,请画出它的晶胞,每个晶胞中环境相同的硫原子有几个?
(4) 在无序的高温结构中,硫原子作什么代表类型的堆积?金属原子占据什么类型的空隙,该类型的空隙被金属原子占据的分数是多少?
(5) 实验表明,CuGaS2和CuFeSnS4与黄铜矿的结构类型相同,请据此推测黄铜矿与铁的氧化数。
9.
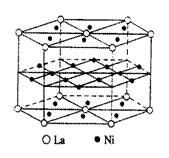 有一种镧(La)、镍合金,属六方晶系,晶胞参数为a = 511pm,c = 397pm
有一种镧(La)、镍合金,属六方晶系,晶胞参数为a = 511pm,c = 397pm
(1) 参考右图,试画出该合金的晶胞
(2) 根据此晶胞,试导出该晶胞的化学式
(3) 该合金能储存氢气,每个晶胞填6个氢原子比较稳定,试求此合金中氢气的密度(假定吸氢后,体积不便)
(4) 试求它与在标准状态下氢气的密度之比
(5) H2能够为镧镍合金所吸收,H2首先需要原子化H2→2H,这是由于H2与合金表面的Ni相互作用所致,试用分子轨道理论解释之。
8. 晶体是质点(分子、离子或原子)在空间有规则地排列而成的,具有整备的外形,以多面体出现的固体物质,在空间里无限地周期性的重复能成为晶体具有代表性的最小单位,称为单元晶胞。
一种Al-Fe合金的立方晶胞如右图
 所示,请回答:
所示,请回答:
(1) 导出此晶体中Fe原子与Al原子的个数比,并写出此种合金的化学式。
(2) 若此晶胞的边长a = 0.578nm,计算此合金的密度
(3) 试求Fe-Al原子之间的最短距离(相对原子的质量:Al:27 Fe:56)
7.
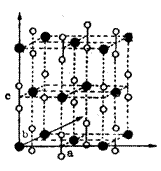 一个Ca和C的二元化合物具有四方晶胞:a = b = 3.87Ǻ,c =
6.37Ǻ,(α = β = γ = 90˚),晶胞图如右图,图中钙原子用较大的黑圆圈表示(●),碳原子用空心圆圈表示(○)。在位于原点的钙原子上面的碳原子的坐标为为x = 0,y = 0,z = 0.406。(1Ǻ = 10 –8cm)
一个Ca和C的二元化合物具有四方晶胞:a = b = 3.87Ǻ,c =
6.37Ǻ,(α = β = γ = 90˚),晶胞图如右图,图中钙原子用较大的黑圆圈表示(●),碳原子用空心圆圈表示(○)。在位于原点的钙原子上面的碳原子的坐标为为x = 0,y = 0,z = 0.406。(1Ǻ = 10 –8cm)
(1) 导出这个化合物的化学式为 ,
(2) 一个晶胞中所含的化学式单位的数目为 ,
(3) C2基团中C-C键长为 Ǻ,
(4) 最短的Ca-C距离为 Ǻ,
(5) 两个最短的非键C××××××××C间距离为 、 Ǻ,
(6) 这一结构与 型离子化合物的结构密切相关。
6. 金属钛属于立方面心晶体。它与碳或氢气反应,形成碳化物或氢化物,外来的原子分别占满金属钛晶体存在的不同类型的空隙。
(1) 氢原子、碳原子分别占有什么样的空隙?对你的判断解释之。
(2) 写出钛化碳和钛化氢的化学式
5. 下列几种具有NaCl结构的化合物,它们之间的阳-阴离子距离列表如下:
|
MgO |
2.10Ǻ |
MgS |
2.60
Ǻ |
MgSe |
2.73
Ǻ |
|
MnO |
2.24
Ǻ |
MnS |
2.59
Ǻ |
MnSe |
2.73
Ǻ |
(1) 你如何解释这些数据?
(2) 从这些数据中,计算S2–离子的半径。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com