
13.为了回收废定影液中的银,往往可以先用H2S使废定影液中的银转化为Ag2S, 再利用氰化氧化法把Ag2S转化为Ag(CN)2-, 最后用锌还原法将Ag(CN)2-还原为金属银。试写出以上过程的化学反应式并计算这些反应的平衡常数。
已知: = 9.1´10-8,
= 9.1´10-8,  = 1.1´10-12,
= 1.1´10-12, 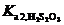 = 2.5´10-2,
= 2.5´10-2,
 = 2.9´1013,
= 2.9´1013,  = 1.3´1021,
= 1.3´1021, = 5.0´1016,
= 5.0´1016,


 = 6.0´10-51,
= 6.0´10-51,  =-0.48V,
=-0.48V,  = 0.40V,
= 0.40V,


 =-0.77V,
=-0.77V,  = 0.799V
= 0.799V
12.25°C时,Cu(s)、CuI(s)、HI(aq)、H2(101.325kPa)等四种物质在水溶液中建立起化学平衡体系。假定在溶液中HI完全电离,且r± = r+ = r- = 1(离子活度系数为1)。已知 Ksp,CuI=5.0´10-12,j  =0.337V,[Cu2+]/[Cu+]2=1.19´106 L×mol-1,请解答下列问题:
=0.337V,[Cu2+]/[Cu+]2=1.19´106 L×mol-1,请解答下列问题:
(1)  写出上述平衡体系的化学方程式1, 并计算它的平衡常数K1,计算上述反应体系平衡时[I-]
写出上述平衡体系的化学方程式1, 并计算它的平衡常数K1,计算上述反应体系平衡时[I-]
(2) 
 将反应1设计为可逆电池通过相应的可逆电池设计,利用已知数据,求出j CuI/Cu及j
Cu+/Cu
将反应1设计为可逆电池通过相应的可逆电池设计,利用已知数据,求出j CuI/Cu及j
Cu+/Cu
11.Xe与F2作用生成XeF2、XeF4、XeF6,反应的平衡常数分别为:
Kp(250°C) Kp(400°C)
Xe(g) + F2(g) = XeF2(g) 8.80´104 3.60´102
Xe(g) +2 F2(g) = XeF4(g) 1.07´108 1.98´103
Xe(g) +3 F2(g) = XeF6(g) 1.06´108 36.0
(1) 现要求制备压力为1atm的XeF2(XeF4含量小于1%)。求在250°C和400°C时,起始物中氙和氟的摩尔比。
(2) 欲制备压力为1atm的XeF6(XeF4含量小于1/10)。问用单质合成XeF6应选取哪一种温度,250°C还是400°C或者两者差别不大?在选取的温度下与分压1.0atm的XeF6达平衡的氟的分压有多大?
(3) 由单质合成XeF4时,应把温度保持在250°C还是400°C(或250°C、400°C均可)?简述理由。
10.在机械制造业中,为了消除金属制品中的残余应力和调整其内部组织,常采用有针对性的热处理工艺,以使制品机械性能达到设计要求。CO和CO2的混合气氛用于热处理时,调节CO/CO2既可以成为氧化性气氛(脱除钢制品中的过量碳),也可成为还原性气氛(保护制留在处理过程中不被氧化或还原制留表面的氧化膜)。反应式为:Fe(s) + CO2(g) = FeO(s) + CO(g),已知在1673K时,
 2CO(g) + O2(g) = 2CO2(g) DG = -278.4kJ·mol-1
2CO(g) + O2(g) = 2CO2(g) DG = -278.4kJ·mol-1
 2Fe(s) + O2(g)
= 2FeO(s) DG = -311.4kJ·mol-1
2Fe(s) + O2(g)
= 2FeO(s) DG = -311.4kJ·mol-1
混合气氛中含有CO、CO2及N2(N2占1.00%, 不参与反应)
(1) CO/CO2比值多大时,混合气氛恰好可以防止铁的氧化?
(2) 此混合气氛中CO和CO2各占多少百分?
(3) 混合气氛中CO和CO2的分压比、体积比、摩尔比及质量比是否相同?若相同,写出依据;若不同,请说明互相换算关系。
(4) 若经由上述气氛保护下的热处理炉中投入一定石灰石碎块。如气氛的总压不变(设为101.3KPa), 石灰石加入对气氛的氧化还原性有何影响?
9.由于NH4+和Rb+大小相等,铵盐和铷盐有许多相似的物理化学性质。假定NH4H的晶格能和RbH的晶格能(-673kJ·mol-1)相等,NH4Cl的晶格能和RbCl的晶格能(-680 kJ·mol-1)相等,请根据计算(用玻恩-哈伯循环)结果:(1) 室温下(298K), NH4H能否稳定存在;(2)比较室温下,NH4Cl和NH4H的稳定性,说明两者稳定性不同的原因。 已知
熵 H2(g) NH3(g) NH4H NH4Cl HCl(g)
 S
/ (J·mol-1·K-1) 129.6 192.3 66.9 94.6
184.0
S
/ (J·mol-1·K-1) 129.6 192.3 66.9 94.6
184.0
 NH3(g)的质子化能DHp = -894.5KkJ·mol-1, D
NH3(g)的质子化能DHp = -894.5KkJ·mol-1, D = 435.5kJ·mol-1, DHCl = 428kJ·mol-1, H的电离能IH = 1317.0kJ·mol-1, H的电子亲合能EH = -78.2kJ·mol-1, Cl的电子亲合能
ECl = -354.5kJ·mol-1。
= 435.5kJ·mol-1, DHCl = 428kJ·mol-1, H的电离能IH = 1317.0kJ·mol-1, H的电子亲合能EH = -78.2kJ·mol-1, Cl的电子亲合能
ECl = -354.5kJ·mol-1。
8.从能量观点出发,人类的食物向人体供应能量。其中一种可折合成葡萄糖在人体里完全氧化释放出来的化学反应能。
(1) 已知 化合物 葡萄糖 H2O(l) CO2 (g)
 DfHm /kJ·mol-1 -1259.8
-285.8 -393.5
DfHm /kJ·mol-1 -1259.8
-285.8 -393.5
设葡萄糖完全氧化释放出的化学反应能全部转化为热。计算1kg 葡萄糖最多可向人体提供多少热量?
(2) 已知用葡萄糖为燃料,设计成燃料电池,其理论标准电动势为1.24V。人体肌肉作功等可归因于生物电过程所产生,因此可折合成葡萄糖氧化作电功释放出来的化学能。计算1kg 葡萄糖最多可作多少功?
(3) 葡萄糖氧化反应所产生的电能与该反应提供的热能是否相等?为什么?在研究食物时,仅谈论能够放出多少“焦”的能量,是否全面?
(4) 设环境温度为20°C, 人体作为一种理想的热机,则1kg 葡萄糖所提供的热能有多少可转化为机械功(按:热机效率为(高温温度-低温温度)/高温温度。温度单位为kJ)? 已知维持人体血液循环体系至少需功8.6´102 kJ。请由此推断人体能量转换机理主要是通过热机还是电化学过程?
7. 已知BaO(s) + H2O(l)
= Ba(OH)2(s) DrHm = -103kJ·mol-1
已知BaO(s) + H2O(l)
= Ba(OH)2(s) DrHm = -103kJ·mol-1
 Ba(OH)2(s) + aq « Ba2+(aq) + 2OH-(aq) DrHm = -52kJ·mol-1
Ba(OH)2(s) + aq « Ba2+(aq) + 2OH-(aq) DrHm = -52kJ·mol-1
 Ba(OH)2·8H2O(s)
+ aq = Ba2+(aq) + 2OH-(aq) DrHm = +64kJ·mol-1
Ba(OH)2·8H2O(s)
+ aq = Ba2+(aq) + 2OH-(aq) DrHm = +64kJ·mol-1
请回答下列问题。若能,给出答案;若不能,简述原因。
(1) 能求得BaO(s)的溶解热吗?
(2) 能求得Ba(OH)2(s)转变成Ba(OH)2·8H2O能量变化吗?
(3) 能求得“O2-”(s) + H2O(l) = 2OH- (s)的能量吗?
(4) 能求得“O2-”(s) + aq ® 2OH- (s)的能量吗?
6.在燃烧煤、石油的废气中,常含有CO、NOx、SO2等气体,排放前,这些有害气体都应尽量除去。请根据下列数据,尽可能多地提出从废气中除去NOx的可能途径(如有反应式,请一并写出),并指出实施时所需的条件。
 DrHm DrHm kJ/mol |
H2 0 |
N2 0 |
O2 0 |
H2O(g) -242 |
CO -110.5 |
CO2 -393.5 |
NO 90.4 |
NO2 33.9 |
NH3 -46.2 |
 S S J/(mol·K) |
131 |
192 |
205 |
189 |
198 |
214 |
211 |
241 |
193 |
5.在铜的电解精练过程中,之所以生成阳极泥(主要由沉入电解槽底部的铜粉组成),据认为是由于电解过程中,在电解质本体溶液里发生了如下反应:2Cu+ =Cu+Cu2+ (I)
已知:298.15K时,下列可逆电极反应的标准还原电极电势
 Cu2+ + 2e ® Cu
j
Cu2+ + 2e ® Cu
j  = +0.340V
= +0.340V
 Cu2+ + e ® Cu+
j
Cu2+ + e ® Cu+
j 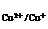 =
+0.167V
=
+0.167V
气体常数R = 8.314J·K-1·mol-1, 法拉第常数F = 96500C·mol-1,
请解答下列问题:
(1) 试计算在298.15K时,若上述反应达平衡时,电解质溶液中Cu+和Cu2+两种离子的相对比例。
(2) 按照上述反应方程式(I), 说明生成阳极泥的原因。
4.


 在298.2K 时,电池:(Pt) H2 (p )½NaOH(aq)½Ag2O(s)
¾ Ag(s)的电动势e = 1.172V, 化学反应:H2(g) + 1/2O2(g) = H2O(g)的D rGm = -228.6 kJ·mol-1, 水的饱和蒸气压为3.168kPa,试求该温度下固体Ag2O的D rGm 及其分解压。已知,F = 96500C·mol-1, R= 8.314J·mol-1·K-1,p =101.3kPa (要求写出必要的运算过程)
在298.2K 时,电池:(Pt) H2 (p )½NaOH(aq)½Ag2O(s)
¾ Ag(s)的电动势e = 1.172V, 化学反应:H2(g) + 1/2O2(g) = H2O(g)的D rGm = -228.6 kJ·mol-1, 水的饱和蒸气压为3.168kPa,试求该温度下固体Ag2O的D rGm 及其分解压。已知,F = 96500C·mol-1, R= 8.314J·mol-1·K-1,p =101.3kPa (要求写出必要的运算过程)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com