
31. (市调研)工业生产粗硅的主要原理为:SiO2+2C Si(粗)+2CO↑。
Si(粗)+2CO↑。
(1)在制粗硅的过程中同时会有碳化硅生成,若二者物质的量之比为1:1,则参加反应的C 和SiO2的质量比为________________。
(2)工业上可通过以下原理由粗硅进一步制纯硅:
Si(粗)+2Cl2(g) SiCl4(l);SiCl4+2H2
SiCl4(l);SiCl4+2H2 Si(纯)+4HCl
Si(纯)+4HCl
若上述反应中Si(粗)和SiCl4的利用率均为80%,制粗硅时有10%的SiO2转化为SiC,则生产25.2吨纯硅需纯度为75%石英砂多少吨?
(3)工业上还可以通过如下图所示的流程制取纯硅:
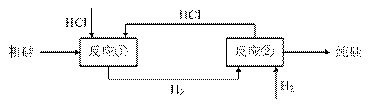
反应①:Si(粗)+3HCl(g) SiHCl3(l)+H2(g)
SiHCl3(l)+H2(g)
反应②:SiHCl3+H2 Si(纯)+3HCl
Si(纯)+3HCl
假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率为75%,反应②中H2的利用率为80%。则在下一轮次的生产中,需补充投入HCl和H2的物质的量之比是多少?
(1)1:2(2)125 t(3)4:1
定量实验相关
30.
(1)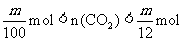 ;(2)0.43(或43%)(3)
;(2)0.43(或43%)(3) (3分)
(3分)
30.(十四校二)工业上利用焦炭在石灰窑中燃烧放热,使石灰石分解生产CO2。主要反应如下:①C+O2→CO2,②CaCO3→CO2↑+CaO(保留2位有效数字)
(1)纯净的CaCO3和焦炭混合物m g在石灰窑中完全反应,所得CO2的物质的量范围是 。
(2)纯净鼗的CaCO3和焦炭按①②完全反应,当窑内配比率 时,窑气中CO2的最大体积分数为
。(设空气只含N2与O2,且体积比为4:1,下同)
时,窑气中CO2的最大体积分数为
。(设空气只含N2与O2,且体积比为4:1,下同)
(3)某次窑气成分如下:O22.0%,CO2.0%,CO241.6%,其余为N2(CaCO3和C在石灰窑中完全反应)。则此次窑内配比率 为何值?
为何值?
31.(浦东一)工业上利用焦炭在石灰窑中燃烧放出的热量,使石灰石分解烧制生石灰。主要反应如下:C+O2→CO2,CaCO3→CaO+ CO2↑。已知:每完全燃烧0.45mol碳所放出的热量正好可以使1molCaCO3完全分解。(精确至小数点后二位)
(1)理论上,石灰窑内的反应混合物中焦炭和石灰石实现最佳配比时,焦炭的质量百分含量为= %。
(2)若烧制0.56吨生石灰,理论上至少产生标况下CO2(不考虑C过量)的体积为 m3。
(3)当窑内配比 时,石灰窑产生气体中CO2的体积分数最多为
。
时,石灰窑产生气体中CO2的体积分数最多为
。
(设空气中O2占1/5,N2占4/5,下同)
(4)若烧制0.56吨生石灰,石灰窑内产生的气体中O2占0.2%、CO占8.4%、CO2占41.4%,其余为N2,则需要焦炭 Kg。
31.(静安一)火法炼锌是将闪锌矿(主要含ZnS)焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1100-1300℃,使锌蒸馏出来(设空气中N2、02的体积分数分别为0.8、0.2)。主要反应为:
焙烧炉中:2ZnS(s)+3 O2 2ZnO(s)+2SO2 (g) ①
2ZnO(s)+2SO2 (g) ①
鼓风炉中:2C(s)+ O2 (g)  2C0(g)
②
2C0(g)
②
鼓风炉中:ZnO(s)+CO(g)  Zn(g)+CO2(g) ③
Zn(g)+CO2(g) ③
(1)ZnS质量分数为62%的闪锌矿(杂质不含锌)锌的质量分数为_______%(保留小数点后一位数字)。
(2)焙烧炉产生的炉气中SO2的体积分数不超过_______%(保留小数点后一位数字)。
(3)鼓风炉容积固定,炉内部分气态物质物质的量浓度(mol/L)变化如下:
|
时间/min |
C0 |
Zn |
CO2 |
|
0 |
0.11 |
0 |
0 |
|
2 |
0.1 |
0.01 |
0.01 |
|
3 |
0.01 |
0.1 |
0.1 |
|
4 |
0.01 |
0.1 |
0.1 |
则鼓风炉中C0的总转化率为___________;若生产中C0的总利用率为98%,则每生产1 mol Zn至少需补充焦炭________g。
(4)若ZnS全部转化为Zn。焙烧炉出来的N2、O2、SO2的混合气体中N2占82.5%,鼓风炉中C0的转化率为62.5%,而O2无剩余。则每生产1molZn,应向焙烧炉和鼓风炉中鼓入新鲜空气共为_____L(STP)。

30.(1)2.4g(3分)(2)95.8%(3分)
30.(卢湾一)(6分)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,实验中有关反应方程式为:3MnO2+6KOH+KClO3 3K2MnO4+KCl+3H2O;3Mn
3K2MnO4+KCl+3H2O;3Mn +4H+ = MnO2↓+2Mn
+4H+ = MnO2↓+2Mn +2H2O
+2H2O
(1)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KMnO4的理论产量为 ;
(2)KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2,该反应的化学方程式是:
2KMnO4+5Na2C2O4+8H2SO4 K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O
K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O
上述制得的KMnO4产品0.165g,与足量Na2C2O4反应完全后产生CO2的体积为112mL(标准状况下),计算该KMnO4的纯度为 。
31. (1)设需精辉铜矿的质量为x,根据元素守恒:
Cu2S -- 2Cu
160 t 128 t
则x= =60 t (2分)
=60 t (2分)
x·80% 38.4 t
(2)设可生产98%的浓H2SO4的质量为y,根据元素守恒:
Cu2S → 2Cu → H2SO4
160 128 98 38.4×92%×98% y×98% y=27.05
(3)
|
反应后固体 的成分 |
Cu |
Cu2S
、Cu |
Cu2O、 Cu |
|
b的取值范围 |
b=5a |
0<b<5a |
5a<b<7.5a |
工业相关
31.(黄浦二)某工厂以精辉铜矿(主要成份为Cu2S)为原料冶炼铜,在炼铜炉内发生如下反应(在
高温条件下进行):
2 Cu2S + 3 O2 → 2 Cu2O + 2 SO2 2 Cu2O + Cu2S → 6 Cu + SO2
(1)若生成38.4吨金属铜,需要含杂质20%的精辉铜矿多少吨?(设杂质不参加反应)
(2)若(1)中产生的二氧化硫用于生产硫酸,可生产98%的硫酸多少吨(二氧化硫转化成三氧化硫的转化率为92%,三氧化硫的吸收率为98%)?
(3)今将a mol Cu2S 与b mol 空气(氧气约占空气体积的20%)在密闭容器中高温下发生反应,请完成下列表格:
|
反应后固体 的成分 |
Cu |
Cu2S 、Cu |
Cu2O、 Cu |
|
b的取值范围 |
|
|
|
31.(1)168L(2分);(2)1.5mol(2分)。
(3)(2分)
|
物质的组成 |
 相应的物质的量之比 相应的物质的量之比 |
|
Cu2S Cu Cu2O Cu |
1:4 1:1 |
(4)0<x≤5 y=0.4x(1分)
5<x≤7.5 y=6-0.8x(1分)
绘图(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com