
30.(南汇二)有总物质的量一定的甲烷和某有机物A(分子式为CaHbOc,a≥1、c≥1、b为正整数)的混合物。
(1)若混合物中甲烷和A不论以何种比例混合,其完全燃烧所生成的水的物质的量不变,则A的组成必须满足的条件是 ;符合此条件的A中,相对分子质量最小的A的分子式为 。
(2)若混合物中甲烷和A不论以何种比例混合,其完全燃烧所消耗的氧气和生成的水的物质的量均不变,则A的组成必须满足的条件是 ;符合此条件的A中,相对分子质量最小的A的分子式为 。
(3)若有机物CxHy(x、y为正整数)和CaHbOc(a≥x)不论以何种比例混合,只要混合物的总物质的量一定,完全燃烧时所消耗的氧气和生成的水的物质的量均不变,那么,这两种有机物的组成必须满足的条件是(用含x、y、a、b、c等的代数式表示)
。
31.(1)NaOH 1.50×10-3mol Na2CO3 5.00×10-4mol(2分)
(2)8.00mL(2分) (3)0.201mg CO2/(g·h)(3分)
有机
31.(十四校二)已知NaOH与Na2CO3的混合溶液用HCl溶液滴定到酚酞变色时,发生了下列二个反应
①NaOH+HCl→NaCl+H2O ②Na2CO3+HCl→NaHCO3+NaCl(保留3位有效数字)
(1)25.00mL 0.1000mol·L-1NaOH溶液吸收标准状况下11.20mLCO2,反应后所得溶液的溶质种类及其物质的量?
(2)取(1)反应后所得溶液10.00mL用0.1000mol·L-1HCl溶液滴定至酚酞终点。需该浓度的HCl溶液多少毫升?
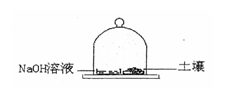 (3)土壤在细菌作用不会释放出CO2,为测定土壤释放CO2的速度。称取25.00g土壤试样置于玻璃钟罩的密闭空间内,同时也放入盛有100.0mLNaOH溶液的圆盘以吸收CO2,48h后取25.00mL圆盘中的溶液,用13.58mL 0.1156mol·L-1HCl溶液滴定至酚酞终点。同样的实验方式不放土壤(空白实验),48h后取25.00mL圆盘中的溶液,需25.43mL上述酸溶液,计算在细菌作用下土壤释放的速度,以mgCO2/[g(土壤)·h]表示。
(3)土壤在细菌作用不会释放出CO2,为测定土壤释放CO2的速度。称取25.00g土壤试样置于玻璃钟罩的密闭空间内,同时也放入盛有100.0mLNaOH溶液的圆盘以吸收CO2,48h后取25.00mL圆盘中的溶液,用13.58mL 0.1156mol·L-1HCl溶液滴定至酚酞终点。同样的实验方式不放土壤(空白实验),48h后取25.00mL圆盘中的溶液,需25.43mL上述酸溶液,计算在细菌作用下土壤释放的速度,以mgCO2/[g(土壤)·h]表示。
31、(1)Na2CO3(2分) (2) +10(3分)原子守恒 (2分)
+10(3分)原子守恒 (2分) ×2 (3分)
×2 (3分)
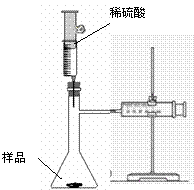
31、(闸北一)某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2。为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:
(1)在一个质量为ag的坩埚中加入一些样品,称得总质量为bg。用酒精灯对其充分加热,冷却后称得其总质量为cg。残留在坩埚中的固体是(填化学式)_____ ____。
(2)另称取相同质量的样品放入瓶中,实验装置如右图所示。推动针筒逐滴加入稀硫酸,至没有气泡产生为止,共消耗10mL稀硫酸。为了保证实验成功,所选用的用于测量气体体积的针筒的最大刻度值应大于或等于_____ ___(mL)(设实验在标准状况下进行)。实验中针筒中收集到的气体折算成标准状况下的体积为VmL(针筒活塞的内壁的摩擦力忽略不计)。该科研小组设称取的每份样品中的Na2CO3、NaHCO3的物质的量分别为x、y,且没有利用化学方程式进行计算,就列出了如下算式:x+y=(V-10)/22400,他们依据的原理是____ _____。根据相似原理,请完成下列算式:
2x+y=_____ _____。由上述两算式,该科研小组通过计算,得出了样品中的Na2CO3、NaHCO3的质量分数。
31.(1)盐酸,碳酸钠溶液;(2)CO32- + H+ → HCO3-、HCO3- + H+ → H2O + CO2↑
(3)0.8 mol/L、1.0 mol/L; (4)0-8.96 n
31.(宝山二)实验室有甲、乙两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定甲、乙两瓶溶液的成分及物质的量浓度,进行如下实验:
①量取25.00 mL甲溶液,向其中缓缓滴入乙溶液15.00 mL,共收集到224 mL(标准状况)气体。
②量取15.00 mL乙溶液,向其中缓缓滴入甲溶液25.00 mL,共收集到112 mL(标准状况)气体。
(1)判断:甲是___________溶液,乙是____________溶液。
(2)实验②中所发生的反应的离子方程式为________________________________________。
(3)甲溶液的物质的量浓度为_________,乙溶液的物质的量浓度为_________。
(4)将n mL甲溶液与等体积乙溶液按上述两种实验方式进行反应,所产生的气体的体积为V mL(标准状况),则V的取值范围是________________。
31、(1)80.33% 或0.80 (2分)(2)铜的物质的量为0.2mol。(3分)
(3) ① (8.96/3 ,8.96 ) (2分)② c(HNO3)= (5.1 + a/2.688)mol/L (3分)
31、(普陀一)将23.9 g表面已锈蚀成铜绿(Cu2(OH)2CO3)的铜片投入120 mL一定浓度的硝酸中,充分反应后,硝酸被还原成NO2和NO,测得反应后溶液PH值为1。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤,干燥后得到29.4 g蓝色固体。(假设反应前后溶液的体积不变)计算:
(1)已锈蚀的铜片中铜元素的质量分数为 。(保留两位小数)
(2) 求铜片中单质铜的物质的量。(写出计算过程)
(3) 若生成 NO2和NO混合气体共a L(S.P.T)。
① a的取值范围为 。② 原硝酸的浓度为多少?(只需用a的代数式表示,写出过程)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com