
26.(12分,各1分)Ⅰ(1)8.5;100ml容量瓶、胶头滴管。(2)镀锌铁皮发生了原电池反应;下方的气泡阻止了酸液与锌层的接触。(3)产生气泡的速率明显下降。
Ⅱ(1)偏大(2)过滤、洗涤;4.30 10-4 Ⅲ c
10-4 Ⅲ c
26.(静安二)白铁即镀锌铁皮,某学习小组的三位同学为了测定锌镀层的厚度,提出了各自的设计方案。
Ⅰ.甲同学的方案是,先用盐酸将镀锌铁皮表面的锌反应掉,通过差量算出锌的质量,然后再由查得的锌密度算出锌层的体积,最后由体积除以镀锌铁皮面积算得锌层厚度。
⑴配制1mol/L的盐酸100ml,需取用36.5%( =1.181g/cm3)的盐酸 ml;配制过程中要用到的玻璃仪器除量筒、烧杯、玻璃棒外,还有
。
=1.181g/cm3)的盐酸 ml;配制过程中要用到的玻璃仪器除量筒、烧杯、玻璃棒外,还有
。
(2)将相同大小相同厚度的普通锌片和镀锌铁皮放入两只试管,各加入同量1mol/L的盐酸,观察镀锌铁皮比普通锌片与盐酸反应速率更快,产生此现象的原因是 ;在翻动横放在烧杯中镀锌铁皮时,发现溶液上方的锌层变薄的速率比下方的锌层快得多,其原因可能是 。
(3)判断镀锌铁皮表面锌恰好反应的现象是 。
Ⅱ.乙同学的意见及方案。
(1)意见:因为难以避免铁也会反应,所以甲同学测出锌的厚度会 (选填偏大或偏小)。
(2)方案: 通过查阅资料,知道Zn(OH)2既可以和酸反应又可以和碱反应,于是设计了如下方案:
 |
 |
||||
|
|||||
步骤③的操作是 ;若使用的镀锌铁片的质量为28.156g ,最后称得灼烧后固体的质量为40.000g,镀锌铁片的长5.10cm,宽5.00cm,锌的密度ρ =7.14g/cm3 ,则锌镀层的厚度为 cm。
Ⅲ.丙同学查得Fe(OH)2 、Zn(OH)2开始沉淀的pH分别为6.5和5.6,认为也可用容量法(即滴定法)检测且准确度更高。该方法的要点是:准确称取m g白铁,加入过量c mol/L的盐酸bml, 再用标准NaOH溶液滴定过量的盐酸,为了防止生成沉淀,应选用的指示剂是 (选填序号)。
a.酚酞 b.石蕊 c.甲基橙
27.(1)反应速率突然减小(或铁片表面生成的气泡突然减少) e 
(2)洗涤、烘干(或干燥) 过滤(3)b、d,加快铁片与硫酸的反应速率,Fe和Cu(
(4)抑制Fe2+、NH4+水解 (5)避免加热过程中晶体受热分解(或被氧化)(6)b、d
27.(浦东二)硫酸亚铁铵(NH4)2SO4•FeSO4•6H2O是一种重要化学试剂,实验室用除去锌镀层的铁片来制取硫酸亚铁铵,流程如下:


请回答下列问题:
(1)确定锌镀层被除去的标志是 ;
计算上述铁片锌镀层的厚度,不需要的数据是 (填编号)。
a.锌的密度ρ(g/cm3) b.镀锌铁片质量m 1(g) c.纯铁片质量m 2(g)
d.镀锌铁片面积S(cm2) e.镀锌铁片厚度h(cm)
锌镀层的厚度为 cm(用含ρ、m 1、m 2…等的代数式表示)。
(2)上述流程中:操作Ⅰ是取出铁片、 、 、称量;操作Ⅱ是 。
(3)A物质可以为 (填编号)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
加入少量A物质的目的是 ,B物质的成分为 。
(4)加少量硫酸调节pH为 1-2的目的是 。
(5)用无水乙醇洗涤潮湿的硫酸亚铁铵晶体是为了除去晶体表面残留的水分,不用加热烘干的原因是 。
(6)鉴定所得晶体中含有Fe2+、NH4+、SO42―离子的实验方法正确的是 (填编号)。
a.取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象
b.取少量样品于试管,加水溶解,加入NaOH溶液,露置于空气中,观察现象
c.取少量样品于试管,加水溶解,加入稀NaOH溶液,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化
d.取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液,观察现象
26.(10分)
[探究一]2Al+2NaOH+2H20=2NaAl02+3H2
 (2分)(1)100 (2分) (2)偏高 (1分)
(2分)(1)100 (2分) (2)偏高 (1分)
[探究二](1)不需要 (1分)
(2)检查装置的气密性;合金完全溶解(或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平,待冷却至室温再读体积等合理答案)(各1分,共2分)
[探究三](1)灼烧后固体的质量 (1分) (2)偏高 (1分)
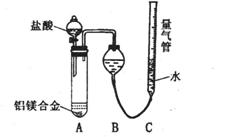
26. (奉贤一) 铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究。填写下列空白。
[探究一]实验方案:铝镁合金 测定剩余固体质量
测定剩余固体质量
实验中发生反应的化学方程式是
实验步骤:(1)称取5.4g铝镁合金粉末样品,投入VmL 2.0mol·L-1NaOH溶液中,充分反应。NaOH溶液的体积V≥
 (2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 (填“偏高”或“偏低”)。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 (填“偏高”或“偏低”)。
[探究二] 实验方案:铝镁合金 测定生成气体的体积实验装置: 问题讨论:
测定生成气体的体积实验装置: 问题讨论:
(1) 某同学提出该实验装置不够完善,应在A、B之间
添加一个干燥、除酸雾的装置。你的意见是: (填“需要”或“不需要”)。
(2) 为使测定结果尽可能精确,实验中应注意的问题是
(写出两点):① ②
[探究三] 实验方案:称量x g铝镁合金粉末.放在如右图所示装置的惰性电热板上,通电使其充分灼烧。
实验方案:称量x g铝镁合金粉末.放在如右图所示装置的惰性电热板上,通电使其充分灼烧。
问题讨论:(1)欲计算Mg的质量分数,该实验中还需测定的数据是
(2)若用空气代替O2进行实验,对测定结果何影响?
(填“偏高”或“偏低”或“无影响”)。
26、(1)吸收空气中的CO2, 偏高 (每空1分,共2分)
(2)装置C反应前后质量 (1分) (3),(5×c×v×10-3×84 )/ m1 (2分)
(4)NaHCO3(其他合理答案也可)(1分)(5)b (1分) (6)蒸发 (1分)
(7)烧杯、酒精灯 (每空1分,共2分) (8)偏高 (2分)
26、(闸北二)为测定碳酸氢钠纯度(含有少量氯化钠),学生设计了如下几个实验方案(每个方案均称取m1 g样品),请回答每个方案中的问题。
[方案I]选用重量法进行测定:可用下图中的装置进行实验。


(1)A装置中NaOH溶液的作用是__________ _______,若直接向试样溶液中鼓人空气会导致实验测定结果________(填“偏高”、“偏低”或“无影响”)
(2)该方案需直接测定的物理量是 。
[方案II]选用滴定法进行测定:
(3)称取m1 g样品,配成100mL溶液,取出20mL,用cmol/L的标准HCl溶液滴定,消耗体积为v mL,则该试样中碳酸氢钠质量分数的计算式为:
[方案III]选用气体体积法进行测定:可用右图中的装置进行实验。
(4)为了减小实验误差,量气管中加入的液体X为
(5)通过实验,测得该试样中碳酸氢钠质量分数偏低,产生这种现象的原因可能是_________
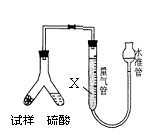 a.测定气体体积时未冷却至室温
a.测定气体体积时未冷却至室温
b.测定气体体积时水准管的水面高于量气管的水面
c.Y型管中留有反应生成的气体
d.气体进入量气管前未用浓硫酸干燥
[方案IV]其操作流程如下:

(6)操作Ⅱ的名称是________________________
(7)实验中需要的仪器有电子天平、蒸发皿、玻璃棒等,还需要的玻璃仪器是
(8)在转移溶液时,如溶液转移不完全,则碳酸氢钠质量分数的测定结果_________(填“偏高”、“偏低”或“无影响”)
26.(1)储液瓶(B瓶)内导管中液面会上升,观察上升液面在1分钟内明显下降(2分)
(2)品红(1分)Mg+2H+→Mg2++H2↑(2分)
(3)① 106.5(1分) ② 25.5(2分) ③ 4.08%(1分) ④ C(1分)
(4)① ②(2分) 0.243(106.5-VB)(1-a%)(2分)
26.(十四校二)利用下图所示实验装置可以测定一条条件下1mol气体的体积,图中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线。将一定质量的镁带和过量的衡硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积。
 实验步骤(1)装配好化学反应气体体积测定仪,作气密性检查。
实验步骤(1)装配好化学反应气体体积测定仪,作气密性检查。
(2)用砂皮擦去镁带表面的氧化物,然后称取0.100g~0.110g的镁带,把数据记录于表格。
(3)取下A瓶加料口的橡皮塞,用小烧杯加入20ml水,再把已称量的镁带加到A瓶的底部,用橡皮塞塞紧加料口。
(4)用注射器从A瓶加料口处抽气,使B瓶导管内外液面持平。
(5)用注射器吸取10mL 3mol/L硫酸,用针头扎进A瓶加料口橡皮塞,将破酸注入A瓶,注入后迅速拔出针头。
(6)当镁带完全反应后,读取C瓶中液体的体积,把数据记录于表格。
(7)用注射器从A瓶加料口处抽气,使B瓶中导管内外液面持平,记录抽出气体的体积,把数据记录于表格。
重复上述操作进行第二次实验,避免偶然误差。
根据上述实验方法回答下列问题:
实验室温度:25℃,压强:101kPa。该条件下1mol氢气体积的理论值:为24.5L
(1)连接装置及气密性检查:当A瓶加料口塞上橡胶塞, 可以确认装置气密性合格。
(2)B中所装液体一般是 (填“水”或“品红”)。
A中发生反应的离子方程式为 。
(3)实验数据如下:温度:25℃(镁元素的相对原子质量为24.3)
|
实验次数 |
m(Mg)g |
硫酸体积ml |
液体量瓶中液体体积ml |
抽出气体体积ml |
氢气体积ml |
计算1mol氢体积L |
|
1 |
0.100 |
10.0 |
110.0 |
6.5 |
X |
|
|
2 |
0.115 |
10.0 |
121.0 |
8.0 |
|
|
①上表中X= 。
②计算1mol氢气体积两次实验的平均值= L。
③计算实验误差:(实验值-理论值)/理论值×100%=
④引起该误关的可能原因 (填字母)
A.镁带中含有跟硫酸不反应的杂质 B.没有除去镁带表面的氧化镁
 C.镁带中含有杂质铝 D.所用稀硫酸不足量
C.镁带中含有杂质铝 D.所用稀硫酸不足量
|
|
实验次数 |
m(Mg)g |
硫酸体积ml |
液体量瓶中液体体积ml |
抽出气体体积ml |
B瓶的一段液柱体积ml |
水汽体积百分含量 |
计算1mol氢体积L |
|
1 |
0.100 |
10.0 |
110.0 |
6.5 |
VB |
a% |
|
1mol氢气体积= L(填写数学表达式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com