
24.(1)H2O2+ 2Fe2+ +2H+ → 2Fe3++2 H2O(2分) ; 0.2NA(1分)
(2)2KMnO4+ 5H2O2+3 H2SO4 → 2MnSO4 + K2SO4 +5O2↑+ 8H2O(2分)
①KMnO4(1分);-1价的O(1分)。 ②2H2O2 →2 H2O+O2↑(1分)
24.(静安二)H2O2既有氧化性又有还原性,在+2价的锰盐或+3价的铬盐等催化下还会发生自身氧化还原反应生成H2O和O2。
(1)完成并配平以下离子方程式: □H2O2+ □Fe2+ +□ → □Fe3++□
若有0.1mol H2O2 参加反应, 转移的电子数为 个.
(2)完成并配平以下化学方程式:
□KMnO4+ □H2O2+ □ → □MnSO4 + □K2SO4 +□ + □H2O
①反应中的氧化剂是 ;被氧化的元素是 。
②若化学方程式中KMnO4、H2O2的系数分别是2和7,也能配平这个方程式,但此时H2O2除了跟KMnO4反应外,还发生的反应是(用化学方程式表示) 。
24. (浦东二)(10分) (1)Cu2O HNO3 Cu(NO3)2 NO H2O (2分)
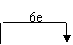 (2)+1价的Cu, HNO3 (各1分) (3)0.2 mol 得到 0.6mol (各1分)
(2)+1价的Cu, HNO3 (各1分) (3)0.2 mol 得到 0.6mol (各1分)
(4)3Cu2O 14HNO3 (2分)(5)使用了较浓的硝酸,产物中有部分二氧化氮生成 (1分)
24.氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e- → NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)请将反应物与生成物分别填入以下空格内:

+ + +
(2)反应中,被氧化的元素是 ,氧化剂是 。
(3)反应中若产生0.2mol气体,则有_________mol氧化剂 (填“得到”或“失去” ) mol电子。
(4)将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。
+ ……
(5)若1mol甲与某浓度较大的硝酸发生反应,反应时,被还原硝酸的物质的量增加,原因是: 。
24.(1) 12Cl2+15NH3→ 4 N2+ 7 NH4Cl + 17 HCl
(2)NH3(1分),NH4Cl 和HCl(各1分,共2分) (3)0.08(1分)
24.(浦东二)已知: 3Cl2+2NH3→N2+6HCl ①
3Cl2+8NH3→N2+6NH4Cl ②
(1)完成并配平下列氧化还原反应方程式,再标出电子转移的方向和数目:
12Cl2+15NH3→ ③
(2)该反应的还原剂是 ,还原产物是 。
(3)若按③反应后产生气体4.704L(标准状况),则被氧化的气体的物质的量是 mol。
24. (奉贤二)已知酸性高锰酸钾溶液可以氧化亚铁离子和草酸根离子,其离子反应式为:
MnO4- + C2O42- + H+ → CO2↑+ Mn2+ + H2O
现称取草酸亚铁[FeC2O4]样品2.00 g(其中的杂质不跟高锰酸钾和硫酸反应),再其溶于稀硫酸,然后用0.200 mol·L-1的酸性高锰酸钾溶液滴定,达到终点时消耗了33.4 mL酸性高锰酸钾溶液。
(1) 请写出MnO4-和Fe2+反应的离子方程式(反应物与生成物分别填入以下空格内)。
MnO4- + Fe2+ + → + + 。
(2)反应中,被还原的元素是 ,还原剂是 。
⑶将高锰酸钾氧化 C2O42- 反应中的氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。

(4)求样品中草酸亚铁的质量分数
24 ⑴ MnO4-+Fe2++H+→ Fe3++Mn2++H2O ⑵+7锰元素 Fe2+⑶ MnO4- + C2O42- ⑷ 80%
24. (8分)(1)在酸性条件下,用(固体)氧化剂将Cl¯氧化成Cl2 (2分)
(8分)(1)在酸性条件下,用(固体)氧化剂将Cl¯氧化成Cl2 (2分)
(2)KClO3 + 5KCl + 3H2SO4→ 3K2SO4 + 3Cl2↑+ 3H2O (3分)
(3)+5价的Cl (1分), 6.02×1023(2分)
24.(闵行二)(8分)已知KMnO4、KClO3、MnO2、Ca(ClO)2等物质在一定条件下均有强氧化性,如下反应均可用作实验室制取Cl2的反应原理:
MnO2+4H++2Cl¯ Mn2++ Cl2↑+2H2O;2MnO4¯+16H++10Cl¯→2Mn2++5Cl2↑+8H2O
Mn2++ Cl2↑+2H2O;2MnO4¯+16H++10Cl¯→2Mn2++5Cl2↑+8H2O
(1)用简明语言概括实验室制取Cl2的反应原理:_______________________________________
_________________________________________________________________________。
(2)已知某一反应体系中共有下列几种物质:KClO3、Cl2、H2O、K2SO4、H2SO4(浓)、KCl,写出此反应的化学方程式,并标明电子转移的方向和数目。
(3)在(2)的反应中,被还原的元素是_________,若反应中有0.6 mol Cl2 生成,则反应中电子转移数目为____________________。
24. (市调研)某反应体系中的物质有:H2SO4、H3PO4、CuSO4、Cu、P4、H2O。
(1)请将P4之外的反应物与生成物分别填入以下空格内。
|
4 |
+ |
|
+ |
|
→ |
|
+ |
|
+ |
|
(2)反应中,被还原的元素是___________________________,还原剂是______________。
(3)将氧化剂与还原剂及其配平的化学计量数填入下列空格中,并标出电子转移的方向和数目。
|
|
|
|
+ |
|
|
|
(1)P4+CuSO4+H2O→H3PO4+Cu+H2SO4(2)CuSO4中正二价的铜元素 白磷(3)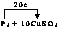
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com