
1.一个带电粒子,沿垂直于磁场的方向射入一匀强磁场.粒子的一段径迹如图3-6-13所示.径迹上的每一小段都可近似看成圆弧.由于带电粒子使沿途的空气电离,粒子的能量逐渐减少(带电量不变),从图中情况可以确定 [ ]

A.粒子从a到b,带正电
B.粒子从b到a,带正电
C.粒子从a到b,带负电
D.粒子从b到a,带负电
3.如图3-6-12所示,在平面直角坐标系xOy的第一象限内,有垂直纸面向里的匀强磁场,磁感应强度为B.一对正、负电子从O点沿纸面以相同速度v射入磁场中,速度方向与磁场边界Ox成30°角,则正、负电子在磁场中运动时间之比为多少?粒子离开磁场时的坐标为多少?

(B组)
2.如图3-6-11所示,在x轴上方(y≥0)存在着垂直于纸面向外的匀强磁场,磁感应强度为B.在原点O有一离子源向x轴上方的各个方向发射出质量为m、电量为q的正离子,速率都为v.对那些在xy平面内运动的离子,在磁场中可能到达的最大x=______,最大y=______.

A.氚核运动半径较大,氚核先回到出发点
B.氚核运动半径较大,氚核先回到出发点
C.氚核运动半径较大,氚核先回到出发点
D.氚核运动半径较大,氚核先回到出发点
31.(1)c、d (2分) (2)①2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2(1分)
② ≥
≥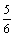 (或1.2a≥b、6a≥5b)(2分),
(或1.2a≥b、6a≥5b)(2分), (2分)③1:5 (3分)
(2分)③1:5 (3分)
解:(2)②将20%的N2O4看作成2份NO2,即NO2共有0.8a+0.2×2a=1.2a(L)
若气体恰好被吸收则:1.2a≥b ∴  ≥
≥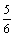
生成的产物NaNO2、NaNO3中钠原子与氮原子均为1:1,所以由原子守恒得:
n(Na2CO3)= n(Na)=
n(Na)= n(N)=
n(N)= [n(NO2)+n(NO)]=
[n(NO2)+n(NO)]= ×
× =
= (mol)
(mol)
∴ c(Na2CO3)=  ÷0.2=
÷0.2= (mol/L)
(mol/L)
③设:2.016 L氮氧化物中含N2O4 x mol、NO2 y mol、NO z mol
 x+y+z=
x+y+z= =0.09
解得: x=0.01(mol)
=0.09
解得: x=0.01(mol)
2x+y+3z=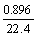 ×4 (得失电子守恒)
y=0.05(mol)
×4 (得失电子守恒)
y=0.05(mol)
 2x+y+z=0.05×2 (氮原子、钠原子守恒) z=0.03(mol)
2x+y+z=0.05×2 (氮原子、钠原子守恒) z=0.03(mol)
∴ V(N2O4):V(NO2) = n(N2O4):n(NO2) =x:y= 1:5
31.(浦东二)在实验室中,氮氧化物废气(主要成分NO2和NO)可以用NaOH溶液来吸收,以除去这些废气,其主要反应为:2NO2 +2 NaOH →NaNO2 + NaNO3 + H2O
NO + NO2 + 2NaOH → 2NaNO2 + H2O
(1)NO和NO2的混合气体的组成可表示为NOX ,该混合气体通入NaOH溶液被完全吸收时,x的值可以为 (填编号)。
a.1.1 b.1.2 c.1.5 d.1.8
(2)若用纯碱溶液处理氮氧化物废气,反应与上述类似,同时放出CO2。
①请写出纯碱溶液吸收NO2的化学方程式 。
②现有标准状况下a升NO2(其中N2O4体积分数为20%)和b升NO的混合气恰好被200mL Na2CO3溶液完全吸收,则a、b应满足的关系为: ;该Na2CO3溶液的物质的量浓度为 mol/L(用含a、b的代数式表示)。
③若在标准状况下,2.016 L氮氧化物的混合气和0.896LO2与1mol/LNa2CO3溶液50mL恰好反应生成NaNO3,则混和气体中N2O4与NO2的体积比为 。写出③的计算过程:
31.(1)0.14(2分)(2)1(2分)(3)13.07(2分)
(4) ① x≤100/11, y = x (2分)
② 100/11<x<400/29,y =80/3﹣29x/15(2分)
31.(松江二)工业上用氨气与空气的混合气在一定条件下制硝酸,发生的反应是:
① 4NH3+5O2 →4NO+6H2O ② 4NO+3O2+2H2O→4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空及计算:
(1)为使氨气恰好完全氧化为一氧化氮,氨气与空气的混合气中氨的体积分数(用小数表示)为________(保留2位小数)。
(2)现将1 mol的氨气与12 mol的空气混合反应,可得到硝酸 mol;
(3)向上述溶液中加入 mL 20%的硝酸(密度为1.11g/mL),才能得到69%的硝酸溶液。
(4)现有100mol的原料气,其中含氨气为xmol,反应后生成的硝酸ymol。在得到硝酸的条件下,写出x与y的关系式。(写出解题过程)
31.(1)8.4(2分) (2) 4 (2分) (3)2∶1(2分) (4)1.20(4分)
31.(金山二)已知:Fe2+能被稀硝酸氧化,反应方程式为:
3Fe(NO3)2 + 4HNO3(稀) → 3 Fe(NO3)3 + NO↑+ 2H2O
现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积与剩余固体的质量如下表:
|
硝酸体积(mL) |
100 |
200 |
300 |
400 |
|
剩余固体(g) |
18.0 |
9.6 |
0 |
0 |
|
放出气体的体积(mL) |
2240 |
4480 |
6720 |
|
(1)放出2240 mL气体时,消耗金属的质量为_______g
(2)稀硝酸的浓度为_______ mol·L-1
(3)计算原混合物中铁和铜的物质的量比为多少?
(4)加入400 mL稀硝酸,反应完全后,计算溶液中硝酸根离子的物质的量。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com