
30.(09苏州)(8分)在日常生活中,我们发现切过咸菜的刀更容易生锈.而除锈用稀盐酸比稀硫酸快。为了进一步验证上述现象,某校师生做了以下相关分组实验,请你根据自己平时课堂学习的体验一起参与讨论并回答相关问题。
[步骤一]未打磨的铝片浸入氯化铜溶液中,迅速产生大量气泡和疏松的紫红色固体,并放热,片刻后溶液由蓝绿色变成无色。
(1)若要正视紫红色固体中是否含有氧化铜,可用 ▲ 溶液(填一试剂)加以检验。
[步骤二]未打磨的铝片浸入硫酸铜溶液中,一段时间内没有明显现象。
(2)比较步骤一、二,你能得出的结论是: ▲ 。
[步骤三]打磨过的铝片浸入硫酸铜溶液中,其操作、现象和结论见下表。
(3)试将“影响因素”选项前恰当的字母序号填入答题卡指定位置。
|
实验操作 |
使用现象 |
对比结论 |
|
Ⅰ.一片用粗砂纸单向用力打磨3次,将其浸入硫酸铜溶液,片刻后用镊子取出。 |
现象一:粗砂纸打磨的在划痕处有少量气泡,附着少量疏松的紫红色固体。 |
现象一与现象二对比,说明 ① ▲ |
|
现象二:粗砂纸打磨的片刻内现象不明显。 |
||
|
Ⅱ.一片用特细砂纸往复打磨数次,再将其浸入硫酸铜溶液,片刻后取出。 |
现象三:特细砂纸打磨的表面产生较多细小气泡,表面均匀附着紫红色固体。 |
现象三与现象一对比,说明 ② ▲ |
|
现象四:特细砂纸打磨的表面一段时间内没有明显现象。 |
现象四与现象三对比,说明 ③ ▲ |
★影响因素:
A.打磨时用力程度及均匀程度不同
B.选用砂纸颗粒粗细程度不同
C.由于摩擦生热又形成了新的氧化膜
(4)比较步骤三各实验操作中用砂纸打磨的作用是: ▲ 。
(5)请仔细观察下图:

试从微观粒子变化的角度分析该反应的实质是:
▲ 。
(1)稀盐酸或稀硫酸 (1分)
(2)氯离子对金属及其氧化物的结构具有较强的破坏作用(或氯离子促进反应的进行或
铜盐溶液中酸根离子种类不同) (1分)
(3)影响因素:①A ②B ③AC (每空1分)
(4)证实氧化膜对反应的影响(是否破坏氧化膜) (1分)
(5)在溶液中,铝比铜活泼,每2个铝原子失去6个电子,变成2个铝离子;每3个铜离子得到6个电子变成3个铜原子 (2分)
16.(15分)
(1)Na、Zn、Ag (每小格1分,共3分)
(2)①不容;烧杯、玻璃棒、铁架台、漏斗
②Fe(或铁);Fe + CuSO4 = FeSO4 + Cu;稀硫酸;Fe + H2SO4 = FeSO4 + H2↑③结晶(或蒸发结晶或冷却结晶) (化学方程式2分,其余梅格1分,共12分)
16.(09泉州)(15分)某校化学实验室废液桶中收集了溶解大量FeSO4、CuSO4的废水,若直接排放到下水道不仅造成重金属污染而且造成浪费。初三(2)班的同学,准备运用刚学到的“常见金属活动性顺序表”结合其他有关化学知识对废水进行处理。
(1)复习常见金属活动顺序表,在下表空格中分别填入对应的元素符号。
K Ca Mg Al Fe Sn Pb (H) Cu Hg Pt Au
 金属活动性由强到弱
金属活动性由强到弱
(2)设计除去铜离子,回收硫酸亚铁晶体和铜的实验方案,讨论有关问题:

 ①废水在加入金属X前需进行过滤,目的是将其中
性杂质除去。进行过滤的操作所需的仪器有: 、 、 、 (请从下图中选择合适仪器,并用仪器名称填写)。
①废水在加入金属X前需进行过滤,目的是将其中
性杂质除去。进行过滤的操作所需的仪器有: 、 、 、 (请从下图中选择合适仪器,并用仪器名称填写)。
②金属X是 ,其加入废水后发生反应的化学方程式为 ;
溶液Y是 ,利用其除去铜中杂质,有关反应的化学方程式为 。
③从滤液中获取硫酸亚铁晶体的操作方法是 。
23.(09娄底)欢欢同学对金属铁的相关知识开展了研究性学习。
(1)实地调查铁制品锈蚀情况如下:
|
调查内容 |
掉漆的自行车 |
露天堆放的钢筋 |
洗净并擦干的菜刀 |
镀铬的铁质水龙头 |
|
铁制品锈蚀情况 |
长时间风吹雨淋掉漆的地方出现锈迹 |
时间长了钢筋表面出现锈层 |
菜刀放置较长时间也不生锈 |
龙头较长时间不生锈 |
由调查结果可知:铁生锈实际上是铁与 35 和 36 等发生反应的过程。
(2)她提出了保护金属资源的下列建议,正确的是 37 (填字母序号)。
A.防止铁制品锈蚀 B.回收利用废旧铁制品 C.任意开采铁矿石
(3) 通过进一步探究铁与硫酸铜溶液反应的实验,可以比较铁与铜的金属活动性强弱,请写出该反应的化学方程式 38 ,该反应类型属于 39 反应。
23题. 35水(或氧气,写化学式记分) 36氧气(或水,写化学式记分)
37 A、B(答A或B均记分) 38.Fe+CuSO4 =FeSO4+Cu(2分)39. 置换
13.(9分)(1)①水、氧气 (每空1分)
②加速铁粉生锈,更快地放出热量 (2分)
(2) ①Fe+ CuSO4 === Fe SO4+ Cu (3分) ②Mg Mn Fe Cu (2分)
(09眉山) 21、(6分)构建知识网络是一种重要的学习方法。右图是关于铁化学性质的知识网络(“→”表示一种物质转化为另一种物质),其中B是密度最小的气体,C为红色固体单质。请回答下列问题:
21、(6分)构建知识网络是一种重要的学习方法。右图是关于铁化学性质的知识网络(“→”表示一种物质转化为另一种物质),其中B是密度最小的气体,C为红色固体单质。请回答下列问题:
(1)A物质的化学式为 。
(2)B物质的一种用途是
。
(3)反应②还需要的一种反应物是
(填化学式)。
(4)写出反应③的方程式,并注明基本反应类型:
( )。
(1)Fe3O4
(2)冶炼金属(作燃料等)
(3)C(或CO或H2)
(4)Fe + CuSO4 = FeSO4 + Cu 置换反应
13.(09福州)(9分)人类生活离不开金属。
(1)铁是生活中常用的金属。图6是某“取暖片”外包装的图片。该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热 。
 ①发热剂需接触到空气才会发热,原因是铁要与 、
①发热剂需接触到空气才会发热,原因是铁要与 、
等物质共同作用才会生锈。
②推测发热剂成分中氯化钠的作用是 。
(2)应用金属活动性顺序能帮助我们进一步学习金属性质。
已知下列各组物质间均能发生置换反应。
A.Fe 和CuSO4 溶液 B.Mg和MnSO4 溶液 C.Mn和FeSO4 溶液
①写出Fe 和CuSO4 溶液反应的化学方程式 。
②Mn、Fe、Mg 、Cu四种金属的活动性由强到弱的顺序 。
24.(09青岛)钢铁是重要的金属材料,在生产、生活中有广泛的用途。建造北京奥运会主体育场“鸟巢”,就是用了大量的钢铁。
(1)钢铁属于______________(填“纯净物”或“混合物”);
(2)每年世界上钢铁的产量很高,钢铁的锈蚀也给人类带来了巨大的损失。铁在空气中锈蚀,实际上是铁跟空气中的__________和___________共同作用的结果;
(3)为了防止钢铁锈蚀,人们常采用在其表面涂刷矿物油或镀上其他金属等覆盖保护膜的方法。这些方法都能防止锈蚀的共同原理是_________________________;
 (4)炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程如下:
(4)炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应过程如下:
焦炭 CO2 CO Fe
请写出第③步反应的化学方程式:_________________________________________;
(5)金属矿物的储量有限,而且不能再生;目前世界上已有50%以上的废钢铁得到回收利用,其目的是_____________________________(填“合理开采矿物”或“节约金属资源”)。
|
(4)3CO + Fe2O3 === 2Fe + 3CO2 (5)节约金属资源
20.(09青岛)在氯化铜和氯化亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀盐酸,没有气泡产生。下列判断正确的是
A.滤出的固体中一定含有铜,可能含有铁和镁
B.滤出的固体一定含有铜,一定不含铁和镁
C.滤液中一定含有氯化镁和氯化亚铁,可能含有氯化铜
D.滤液中一定含有氯化镁、氯化亚铁、氯化铜
6、(09临沂)将一定量的镁条放入到过量的稀盐酸中,下列表示反应过程中变化关系的曲线,正确的是( )
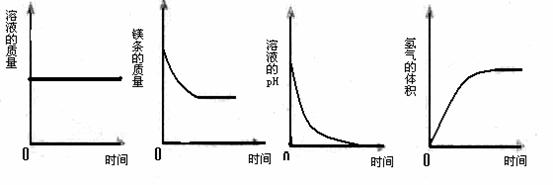
A. B。. C。 D.
(09青岛)
|
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
4、(09临沂)光亮的铁钉在下列几种情况下,最不容易生锈的是( )

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com