
22.(10分)(1)  (2)酸+盐 金属+盐 (其他合理答案也可)
(2)酸+盐 金属+盐 (其他合理答案也可)
(3) ①
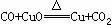 ②步骤Ⅰ和步骤Ⅴ
②步骤Ⅰ和步骤Ⅴ
(09潍坊) 23.(8分)海洋是个巨大的资源宝库,它不仅孕育着无数的生命,还含有大量的化学物质。
I .海水提溴。从海水中提取的溴约占世界溴产量的 ,工业上常用“吹出法”制溴,其工艺流程如下:
,工业上常用“吹出法”制溴,其工艺流程如下:

试回答:
(1)步骤②中的化学方程式为2NaBr+C12=2NaCl+Br2,其反应类型是 ,
(2)非金属单质也具有类似金属与盐溶液之间的反应规律,如在溶液中可发生下列反应:C12+2KBr=2KCl+Br2 Br2+2KI=2KBr2+I2
由此可判断C12、I2、Br2活动性由强到弱顺序是_______。
Ⅱ .食盐制碱。我国著名化学家侯德榜发明的联合制碱法的主要过程是:①向浓氨水中通人足量的二氧化碳生成碳酸氢铵溶液;②然后向溶液中加入食盐细粒充分搅拌,控制条件,利用物质的性质不同,两者发生反应生成碳酸氢钠,便有晶体析出;③将析出的碳酸氢钠加热制得碳酸钠、二氧化碳和水。
四种盐在不同温度下的溶解度表:
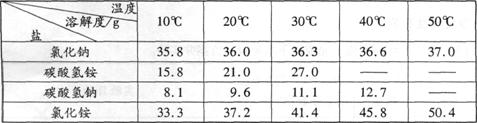
请回答:
(1)碳酸氢铵的化学式是 。
(2)由上表分析过程②中能发生反应的原因是 。
(3)过程③中反应的化学方程式是 。
26.(9分)(1)蒸馏法
(2)蒸发结晶 ①③②⑤⑦④⑥(或①⑤③②⑦④⑥或①③⑤②⑦④⑥)
(3) Mg(OH)2 MgCl2 通电 Mg+Cl2↑ 后者是经过富集和分离后的溶液(或海水中含有氯化钠等多种溶质,氯化镁的浓度很低)
(4) NaCl+NH3+H2O+CO2=NaHCO3+NH4Cl 2NaHCO3△ Na2CO3+ H2O+CO2↑ 氨气溶于水形成碱性溶液,更易于吸收二氧化碳
(09潍坊) 22.(10分)小梅同学学习了单质、氧化物、酸、碱、盐性质后,发现许多不同类别的物质反应时能生产盐,于是她构建了下图所示的知识网络图。
 铜及其化合物在工业上有重要的应用。借助网络图回答:
铜及其化合物在工业上有重要的应用。借助网络图回答:
(1)写出用酸和碱生产硫酸铜的化学方程式:
。
(2)请你把图中①②处补充完整,要求不能与图中已有信息重复。
① ;② 。
(3)根据网络图可制备物质。例如,某回收含铜电缆废料的工厂有下列制铜的方案:

①写出下列步骤中的化学方程式:
步骤Ⅲ: 。
步骤V: 。 。
②上述方案中可能造成空气污染的步骤是 。 .
27.(09南京)(6分)框图中的物质为初中化学所学的物质,其叫属于盐的是B、C、M、N,属于氧化物的是F、G;胃液中含有适量的A,可帮助消化;C是家庭中重要的调味品之-一;D常用于改良酸性土壤。图中“---.”表示两端的物质问能发生化学反应:“→’表示物质间存在转化关系;部分反应物或生成物已略去。
 (1)C物质是由
(选填“分子”、“原子”或 “离子”)构成的。
(1)C物质是由
(选填“分子”、“原子”或 “离子”)构成的。
(2)A与镁条反应能 (选填“放出”、“吸收”)
热量。
(3)写出D的俗名: ;
写出化学式:B N
(1)写小G→M的化学方程式:
(09烟台) 26.(9分)海水是一种重要的自然资源。以下是我市对海水资源的部分利用。
(1)从海水中获取淡水。常用的操作方法是 。
(2)从海水中获得氯化钠。将海水进行 可得到粗盐;为除去粗盐中含有
的SO42-、Ca2+、Mg2+等杂质,-有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤。正确的操作顺序是 。(用序号填一种合理组合)。
 (3)从海水中得到金属镁。下图是从海水中提取镁的简单流程。
(3)从海水中得到金属镁。下图是从海水中提取镁的简单流程。
上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为 ,由无水MgCl2制取Mg的化学方程式为 。海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同:
。
(4)海水“制碱”。下图是海水“制碱”的部分简单流程。

步骤Ⅲ、步骤Ⅳ反应的化学方程式为: 、
。
制氨盐水的过程中要先通入氨气,再通入二氧化碳。如果反过来,二氧化碳的吸收率会降低。这是因为 。
16.(5分)⑴做锅/加工成丝/加工成片 ⑵金属X表面有红色固体生成
⑶
|
你的一种猜想 |
操作 |
现象 |
结论 |
|
金属X的活动性比镁弱 |
取经打磨的金属X固体,放入氯化镁溶液中。 |
无明显现象 |
假设成立,金属X的活动性比镁弱 |
15.(11分)
[提出猜想]所得溶液可能呈碱性,也可能呈 酸 性,还可能呈 中 性。
[实验验证]
|
|
实验现象 |
结论 |
|
|
无色酚酞试液变 红 |
|
|
|
溶液呈 酸性或中性 |
[分析与思考]
⑴OH-;氯化铁/氯化铜(化学式也可),FeCl3+3NaOH = Fe(OH)3↓+3NaCl CuCl2 +2NaOH = Cu(OH)2↓+2NaCl
⑵有所泡产生;Zn+ 2HCl = ZnCl2+ H2↑
(09达州)16.(5分)下表是生活中某种常见金属X的部分性质:
|
颜色状态 |
硬度 |
密度 |
熔点 |
导电性 |
导热性 |
延展性 |
|
银白色固体 |
软 |
7.9g/cm3 |
1525℃ |
良好 |
良好 |
良好 |
将金属X投入盐酸中,有大量气泡生成。根据上述信息,回答下列问题:
⑴试推断金属X可能的一种用途 。
⑵将金属X放入硫酸铜溶液中,观察到的现象是 。
⑶请自选试剂,设计实验比较金属X与Mg的活动性强弱。完成下表:
|
你的一种猜想 |
操作 |
现象 |
结论 |
|
|
|
|
假设成立,金属X的活动性比镁弱 |
15.(09达州)(11分)小亮在做“盐酸中和氢氧化钠溶液”的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度。于是他对所得溶液的酸碱性进行探究。
[探究目的]探究所得溶液的酸碱性
[提出猜想]所得溶液可能呈碱性,也可能呈 性,还可能呈 性。
[实验验证]
|
实验操作 |
实验现象 |
结论 |
|
用试管取该溶液1-2mL,滴入1-2滴无色酚酞试液,振荡 |
无色酚酞试液变
|
溶液呈碱性 |
|
无色酚酞试液不变色 |
溶液呈
|
[分析与思考]
⑴若溶液呈碱性,则溶液中使其呈碱性的离子是 (填写微粒符号),为避免碱性溶液污染环境,小亮对所得溶液进行了如下处理:向溶液中逐滴加入 溶液,直到不再产生沉淀为止。然后过滤,把滤液倒入蒸发皿中加热,得到氯化钠晶体,该过程涉及的化学方程式为 。
⑵若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
方案一:取样,加入碳酸钠溶液,若观察到 ,则所取溶液呈酸性;若无明显现象,则呈中性。
方案二:取样,加入金属锌,若有所泡产生,则所取溶液呈酸性,该反应的化学方程式为 ;若无明显现象,则呈中性。
30.(09兰州)(4分)化学就在我们身边,它与我们的生活息息相关。请从A熟石灰、B苏打、C一氧化碳、D氮气、E浓硫酸、F盐酸这六种物质中,选择适当的物质用序号填空。
(1)能与酸发生中和反应的物质是 ; (2)常用于工业除锈的试剂是 ;
(3)有毒的物质是 ; (4)我国著名化学家侯德榜发明的联合制碱法中的“碱”是指 。
28.(09扬州)(16分)菠菜营养丰富,素有“蔬菜之王”的美称。民间流传:菠菜豆腐同食,易得结石。某化学兴趣小组对“菠菜豆腐是否不能同食”等问题进行了探究。
[查阅资料]①菠菜含有丰富的铁、草酸盐、碳酸盐等,豆腐中含有丰富的蛋白质及钙盐。
②人体结石的主要成分:草酸钙(CaC2O4)
③醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐等。
[提出猜想]“菠菜豆腐不能同食”的原因可能是 ▲ 。
 [探究一]菠菜中部分成分分析
[探究一]菠菜中部分成分分析
(1)步骤③中加入足量的CaCl2溶液的目的 ▲ 。
(2)已知气体C能使澄清石灰水变浑浊,醋酸的化学式用HAC表示,写出步骤④的化学反
应方程式 ▲ 。沉淀A、B的质量关系为:m(A) ▲ m(B)(填“>”、“<”
或“=”)。
(3)白色沉淀B的化学式为 ▲ ,由此可见菠菜豆腐不能同食。以下饮食观点正确的是
▲ (填字母)
A.禁吃菠菜 B.高钙牛奶可与菠菜同食
C.菠菜烹饪时可用开水烫,可降低草酸盐含量
[探究二]某草酸钙晶体(CaC2O4·xH2O)热分解研究
 按下图装置将草酸钙晶体样品高温加热,使其完全分解,对所得气体产物进行探究(假设装置中各试剂均足量)
按下图装置将草酸钙晶体样品高温加热,使其完全分解,对所得气体产物进行探究(假设装置中各试剂均足量)
(4)①反应开始前通入氮气的目的是 ▲ 。
②装置B中硫酸铜粉末变蓝,说明产物中有 ▲ ,C、F中澄清石灰水均变浑浊,E
中CuO变红,说明产物还有 ▲ 和 ▲ ,经检验A中残留固体为氧化物。
③对上述装置从环保角度提一个改进建议 ▲ 。
(5)某研究所利用SDT Q600热分析仪对草酸钙晶体(CaC2O4·xH2O)进行热分解,获得
 相关数据,绘制成固体质量-分解温度的关系如右图。
相关数据,绘制成固体质量-分解温度的关系如右图。
①800℃以上时,固体成分的化学式为 ▲ 。
②计算CaC2O4·xH2O中的x(写出计算过程,
CaC2O4的相对分子质量:128)。
③残留固体为CaC2O4时的温度范围 ▲ ,
写出固体质量由12.8g变为10.0g时的化学
方程式 ▲ 。
26.(09扬州)(8分)下图是氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图,根据要求回答问题。

(1)铁的另两种常见氧化物的化学式是 ▲ 、 ▲ 。
(2)加水溶解过程中,在实验室里通常要使用的玻璃仪器有烧杯和 ▲ ,操作A的名称
是 ▲ 。
(3 )副产品P是 ▲ ,由溶液N获得该副产品的操作顺序是b→ ▲ → ▲ →d。
a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶水
|
Fe3O4的过程中发生的反应为Fe(OH)2 + 2Fe(OH)3 === Fe3O4 + 4H2O,控制“一
定量空气 ”的目的是 ▲ ,沉淀M中Fe(OH)2 和Fe(OH)3的最佳质量比为 ▲ 。
(相对分子质量:Fe(OH)2 -90,Fe(OH)3-107)
3.(1)Na2CO3溶液 (2)CO2 (3)N a2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH
(该题答案不唯一,只要合理均给分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com