
21.(10分)取等物质的量浓度的NaOH溶液
两份A和B,每份50mL,向其中各通入
一定量的CO2,然后各取溶液10mL,分别
将其稀释为100mL,再分别向稀释后的溶
液中逐滴加入0.1mol/L的盐酸,标准状况
下产生的CO2气体体积与所加盐酸体积之
间的关系如右图所示,试回答下列问题:
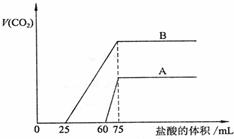
(1)曲线A表明,原溶液中通入CO2后,所得溶液中溶质的化学式为 ,加盐酸后产生CO2体积的最大值为 mL。
(2)曲线B表明,原溶液中通入CO2后,所得溶液中溶质的化学式为 ,加盐酸后产生CO2体积最大值为 mL。
(3)通过计算,求出原NaOH溶液的物质的量浓度为 。
20. (10分)M为一种常见的液体试剂。下列物质在一定条件下可发生如下图所示的转化关系。回答下列问题:
(10分)M为一种常见的液体试剂。下列物质在一定条件下可发生如下图所示的转化关系。回答下列问题:
(1)写出淡黄色粉末和M反应的化学方程式 ;
(2)若固体乙是硫化铝,则:①C的化学式是 ,G的化学式是 ;
②H溶解于A溶液的离子方程式是 ;
 (3)若白色沉淀D不能溶解于A溶液,气体C能使湿润的红色试纸变蓝,则固体乙的化学式可能是 。
(3)若白色沉淀D不能溶解于A溶液,气体C能使湿润的红色试纸变蓝,则固体乙的化学式可能是 。
19.(12分)四氯化钛(TiCl4)是工业上制备金属钛的重要原料。常温下,它是一
种极易水解的无色液体,沸点为136.4℃。工业制备TiCl4和钛的反应分别为:
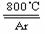 TiO2 + 2C + 2Cl2
TiO2 + 2C + 2Cl2  TiCl4 + 2CO ; TiCl4 +2Mg
Ti + 2MgCl2
TiCl4 + 2CO ; TiCl4 +2Mg
Ti + 2MgCl2
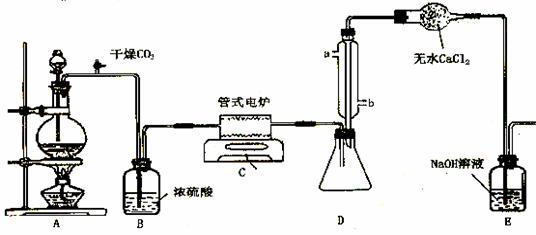
下图是实验室制备TiCl4的反应装置,主要操作步骤:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④ 将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
 试回答下列问题:
试回答下列问题:
(1)正确的操作顺序为(填序号)__________________ ;
(2)装置A中的反应的离子方程式为__________________________ ;
(3)操作①的目的是_________________________________ ;
(4)装置D中冷凝管进水口的位置是(填a或b)__________,
装置E的作用是___________________________________;

(5)工业上常用金属镁在800℃高温和氩气氛围中还原TiCl4的方法制备钛,
氩气的作用是_
_
。
18.(12分)由新型无机非金属材料制成的无水冷发动机,热效率高、寿命长。这
类材料中研究较多的是化合物G。
(1) 化合物G 的相对分子质量为140,G 中含硅元素,其质量分数为60%,另有元素Y。G 可以由化合物E(含两种元素)与NH3反应而生成,同时产生HCl 气体。则G 和E的化学式分别为______________、______________。
(2) 粉末状G 能够与氧气反应,所得产物中有一种是空气中的主要成分,另
一种是工业上生产玻璃的主要原料。请写出化合物G 与氧气反应的化学方程
式 。
(3) 常压下在G 中添加氧化铝,经高温烧结可制成一种高强度、超硬度、耐
磨损、抗腐蚀的陶瓷材料,它的商品名叫“赛伦”,化学通式可表示为:
Si6-XAlXOXY8-X。在接近1700℃时x的极限值约为4.0,在1400℃时 x为2.0,以保持整个化合物呈电中性。则赛伦中以下元素的化合价分别为:Si__ __、
Y______,塞伦的晶体类型__________。
17.(8分)NaNO2大量用于染料工业和有机合成工业中,然而由于NaNO2有毒性,
将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才
能排放。处理方法之一(化学反应)如下:
__NaNO2+__KI+__ ______
- __NO+__I2+__K2SO4+__Na2SO4+__
__ _
(1)请完成该化学方程式并配平;
(2)在上述反应中,若要生成25.4 g I2,则电子转移了__________个;
(3)上述反应中,氧化产物是__________。
16.K35ClO3晶体与H37Cl溶液反应生成氯气、氯化钾和水;则此反应生成的氯气的平均相对分子质量接近
( )
A.73.3 B.73 C.74 D.70.6
第Ⅱ卷 (非选择题 共52分)
15.某研究性学习小组为了探索镁粉与溴水反应的机理,做了如下四组实验:
①将镁粉投入冷水中,未见任何现象;②将镁粉放入溴水中,观察到只是开
始时产生极少量的气泡,但溴水的颜色逐渐褪去;③将镁粉放入液溴中,未
观察到任何明显现象;④向含足量镁粉的液溴中滴加几滴水,观察到溴的红
棕色很快褪去。则下列关于镁与溴水的反应机理的论述中正确的是 ( )
A.镁粉只直接与溴水中的溴反应 B.镁粉在水的催化下与溴发生反应
C.产生极少量的气泡是由于镁粉与水反应得到 D.镁粉只与溴水中的酸反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com