
30. (5分)已知 ,(放热反应)在一个体积不变的密闭容器中加入2
,(放热反应)在一个体积不变的密闭容器中加入2 A、1
A、1 B及固体催化剂,在500℃时充分反应达到平衡后C的体积分数为40﹪。
B及固体催化剂,在500℃时充分反应达到平衡后C的体积分数为40﹪。
(1)若将反应温度升高到800℃,则 (正)_________(填“增大”、“减小”或“不变”),且平衡将向_________反应方向移动(填“正”或“逆”)。
(正)_________(填“增大”、“减小”或“不变”),且平衡将向_________反应方向移动(填“正”或“逆”)。
(2)若在原容器中只加入2 C,500℃时充分反应达到平衡时,C的体积分数为_____40﹪(填入“>”、“<”或“=”)。
C,500℃时充分反应达到平衡时,C的体积分数为_____40﹪(填入“>”、“<”或“=”)。
 (3)500℃,在相同的容器中,若起始通入一定物质的量A、B、C,使平衡时C的体积分数为40﹪,且起始时反应向正反方向进行,则加入B的物质的量的取值范围是 _____________。
(3)500℃,在相同的容器中,若起始通入一定物质的量A、B、C,使平衡时C的体积分数为40﹪,且起始时反应向正反方向进行,则加入B的物质的量的取值范围是 _____________。
29、(6分)t0C下在一密闭容器中充入4mol N2O5发生如下反应:

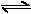 N2O5 N2O3
+ O2 N2O3
N2O
+ O2
N2O5 N2O3
+ O2 N2O3
N2O
+ O2
测得达平衡时O2为4.5mol, N2O3 为1.62mol,
则平衡时N2O为 mol,N2O5为 mol
28.(4分)现有下列两组溶液(Ⅰ)组:0.1mol/L的醋酸和盐酸,(Ⅱ)组:pH值=11
的氨水和氢氧化钠溶液。若将它们加水稀释相同的倍数,试比较(Ⅰ)组和(Ⅱ)组溶液pH值的大小: (Ⅰ)组,pH盐酸 pH醋酸
(Ⅱ)组,pH氢氧化钠溶液 pH氨水
27.(7分)某温度(t0C)时水的Kw =10-13 ,则该温度(填大于、小于或等于) 250C,其理由是 。将此温度下 pH =11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,
(1)若所得混合液为中性,则a : b== ;
(2)若所得混合液的 pH == 2,则 a : b== ;
26、(7分)下列物质:①氯化钠溶液;②氯化铵固体;③铜;④石墨;⑤熔融NaOH;
⑥稀硫酸;⑦甲酸;
属于强电解质的是 能导电的是 。
25. (9分)在一定温度下,把4 mol SO2和2 molO2通入一个一定容积的密闭容器里,发生如下反应:2SO2 + O2 2SO3
,当此反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中维持温度不变,令a、b、c分别代表初始加入的SO2 、O2 和SO3 的物质的量(mol),如a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时完全相同。请填写下列空白:
(9分)在一定温度下,把4 mol SO2和2 molO2通入一个一定容积的密闭容器里,发生如下反应:2SO2 + O2 2SO3
,当此反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中维持温度不变,令a、b、c分别代表初始加入的SO2 、O2 和SO3 的物质的量(mol),如a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时完全相同。请填写下列空白:
(1)若a=0,b=0,则c= ;
(2)若a=0.5,则b= 和c= ;
(3)a、b、c必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,
另一个只含b和c);
24、 在某容积一定的密闭容器中,可逆反应A(气)+ B(气) xC(气);有如下图(a)、(b)所示的关系曲线,试判断下列对图b的说法正确的是( )
在某容积一定的密闭容器中,可逆反应A(气)+ B(气) xC(气);有如下图(a)、(b)所示的关系曲线,试判断下列对图b的说法正确的是( )


|
|
|
|
|
|
|
|
|
|
|
|
(a) (b)
A. P3> P4 y轴表示A的转化率 B. P3> P4 y轴表示B的体积分数
C. P3< P4 y轴表示混合气体的密度 D. P3< P4 y轴表示混合气体的平均式量
第II卷(非选择题 共48分)
23、 2008年是勒夏特列(1850-1936)诞辰158周年,他发现的平衡移动原理在工、农业生产和日常生活中有许多重要应用。下列事实中,能用勒夏特列原理解释的是( )
A. 向氯水中加食盐不利于氯气的溶解
B. 由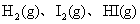 组成的平衡体系,加压后颜色加深
组成的平衡体系,加压后颜色加深
C. SO2催化氧化成SO3的反应,往往需要使用催化剂
D. 500℃左右比室温更有利于合成氨的反应
22、在一定条件下,在容积为2L的密闭容器中,将2 mol 气体M和3 mol N气体混合,发生如下反应:2M(g) + 3N(g)  x Q(g) +3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是( )
x Q(g) +3R(g),该反应达平衡时,生成2.4mol R,并测得Q的浓度为0.4 mol/L,下列有关叙述正确的是( )
A.x值为2 B. 混合气体的密度增大
C.平衡时N的浓度为0.3 mol/L D. N的转化率为60%
21、在密闭容器中进行如下反应:X2(g)+Y2(g)
 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是 ( )
A. Z为0.3mol/L B. Y2为0.4mol/L C. X2为0.2mol/L D. Z为0.4mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com