
7.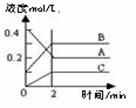 某温度下,密闭容器中发生反应aX(g)
某温度下,密闭容器中发生反应aX(g) bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是(
)。
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是(
)。
A.可逆反应的化学计量数数:a>b+c
B.压缩容器的容积时,v正增大,v逆减小
C.达到新平衡时,物质X的转化率减小
D.达到新平衡时,混合物中Z的质量分数增大
6.一定条件下反应mA(g)+ nB(g) pC(g)+
qD(g)在一密闭容器中进行,测得平均反应速度v(C)=
2v(B)。若反应达平衡后保持温度不变,加大体系压强时平衡不移动,则m、n、p、q的数值可以是 (
)。
pC(g)+
qD(g)在一密闭容器中进行,测得平均反应速度v(C)=
2v(B)。若反应达平衡后保持温度不变,加大体系压强时平衡不移动,则m、n、p、q的数值可以是 (
)。
A.2、6、3、5 B.3、1、2、2 C.3、1、2、1 D.1、3、2、2
5. 在一定固定的密闭容器中,放入3mol X(g)和2mol Y(g),在一定条件下发生反应:


 达平衡后,容器内温度不变,混合气体的压强比原
达平衡后,容器内温度不变,混合气体的压强比原
来增加5%,X的浓度减小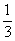 ,则该反应方程式中的n值是( )
,则该反应方程式中的n值是( )
A. 3 B. 4 C. 5 D. 6
4. 对于反应M+N→P,如果温度每升高10℃,速率增加为原来的3倍。在10℃时完成反应的10%需要54min,将温度提高到40℃完成反应的10%需要的时间为 ( )
A. 2min B. 3min C. 6min D. 9min
3. 在一定温度下,下列叙述不是可逆反应
达到平衡的标志的是( )
在一定温度下,下列叙述不是可逆反应
达到平衡的标志的是( )
(1)C的生成速率与C的分解速率相等;(2)单位时间生成amol A,同时生成3amol B;
(3)A、B、C的浓度不再变化;(4)A、B、C的压强不再变化;(5)混合气体的总压强不再变化;(6)混合气体的物质的量不再变化;(7)单位时间消耗amol A,同时生成3amol B;(8)A、B、C的分子数目比为1:3:2。
A. (2)(8) B. (7)(4) C. (1)(3) D. (5)(6)
2. 在2L的密闭容器中,发生以下反应:2A(g)+B(g)  2C(g)+D(g),若最初加入的A和B都是4mol,在前10s A的平均反应速度为0.08mol/(L·s),则10s时容器中B的物质的量是( )
2C(g)+D(g),若最初加入的A和B都是4mol,在前10s A的平均反应速度为0.08mol/(L·s),则10s时容器中B的物质的量是( )
A. 3.6mol B. 3.2mol C. 2.4mol D. 1.2mol
1. 在2A+B == 3C+4D反应中,下面表示的反应速率最快的是 ( )
A. VA=3.0mol·L-1·min-1 B. VB=0.28mol·L-1·S-1
C. VC=4.8mol·L-1·min-1 D. VD=1.0mol·L-1·S-1
22. (14分) 红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和PCl5
(g)。反应过程和能量关系如图所示(图中的ΔH表示生成lmol产物的数据)。
 根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是
__________________________________________________________________________;
(2)PCl5分解成PCl3 和Cl2的热化学方程式是
__________________________________________________________________________;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加人0.80 mol PC15,反应达平衡时PC15还剩0.60 mol,其分解率α1等于________;若反应温度由Tl升高到T2,平衡时PC15的分解率α2为,α2_______α1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5原因是______________________________________________________;
(4)P和Cl2分两步反应生成1mol PCl5的ΔH3 =_____________________,P和Cl2g一步反应生成1 mol PCl5的ΔH4___________ΔH3;(填“大于”、“小于”或“等于”)
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式
______________________________________________________________________。
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是
__________________________________________________________________________;
(2)PCl5分解成PCl3 和Cl2的热化学方程式是
__________________________________________________________________________;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加人0.80 mol PC15,反应达平衡时PC15还剩0.60 mol,其分解率α1等于________;若反应温度由Tl升高到T2,平衡时PC15的分解率α2为,α2_______α1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5原因是______________________________________________________;
(4)P和Cl2分两步反应生成1mol PCl5的ΔH3 =_____________________,P和Cl2g一步反应生成1 mol PCl5的ΔH4___________ΔH3;(填“大于”、“小于”或“等于”)
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式
______________________________________________________________________。
21.(8分)合成氨工业对化学工业和国防工业具有重要意义。设在容积为2.0 L的密闭容器中充入0.80 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为20%。
(1) 该条件下反应2NH3(g) N2(g)+ 3H2(g)的平衡常数为
。
N2(g)+ 3H2(g)的平衡常数为
。
(2)相同条件下,在另一相同容器中充入a
mol N2(g)和b
mo1 H2(g),达到平衡时,测得容器中NH3为0.8 mol,H2为2.0 mol,则 。
。
(3)工业上可利用CH4(g)+H2O(g) CO(g)+3H2(g)反应生产合成氨原料气H2。已知温度、压强和水碳比[
CO(g)+3H2(g)反应生产合成氨原料气H2。已知温度、压强和水碳比[ ]对甲烷蒸汽转化反应的影响如下图:
]对甲烷蒸汽转化反应的影响如下图:

图1(水碳比为3) 图2(水碳比为3) 图3(800℃)
①降低反应的水碳比平衡常数K__________(选填“增大”、“减小”或“不变”);
升高温度,平衡向____________方向移动(选正反应或逆反应)。
②图2中,两条曲线所示温度的关系是:t1_____t2(选填>、=或<);
图1中,在800℃、2MPa比1MPa时的甲烷含量_______(选填高、低或不变),
20.(8分)二氧化硫是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。已知:硫酸生产中,将SO2催化氧化成SO3的化学方程式为:
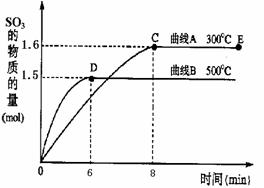
 2SO2+O2 2SO3。 将2.0mol SO2和1.0mol O2置于10L密闭容器中,在300℃和500℃
2SO2+O2 2SO3。 将2.0mol SO2和1.0mol O2置于10L密闭容器中,在300℃和500℃
条件下得到如上所示图象,回答下列问题:
①300℃时,平衡常数K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
②在500℃时,从反应开始到平衡,氧气的平均反应速率v(O2)= 。
③在其他条件不变的情况下,对处于E点的反应体系,体积压缩到原来的1/2,下列有关该体系的说法正确的是 。
A.氧气的浓度减少 B.正反应速率加快,逆反应速率也加快
C.SO3的物质的量增加 D.重新平衡时,n(O2)/n(SO3)增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com