
31.(8分)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.50%。工业上常通过下列反应制备CuCl
2CuSO4+Na2SO3+2NaCl+Na2CO3===2CuCl↓+3Na2SO4+CO2↑
⑴ CuCl制备过程中需要配置质量分数为20.0%的CuSO4溶液,试计算配置该溶液所需的CuSO4·5H2O与H2O的质量之比。
⑵ 准确称取所配置的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1的Ce(SO4)2溶液滴定到终点,消耗24.60mLCe(SO4)2溶液。有关反化学反应为
Fe3++CuCl===Fe2++Cu2++Cl- Ce4++Fe2+===Fe3++Ce3+
通过计算说明上述样品中CuCl的质量分数是否符合标准。
衡阳市八中2010届高三第二次月考
30.(4分)⑴取1.43g Na2CO3·10H2O溶于水配成100ml溶液。Na2CO3物质的量浓度为___________________
(2) 取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.004mol/L,求加入蒸馏水的体积(设稀释时,对溶液体积的影响忽略不计)_____________________________
29.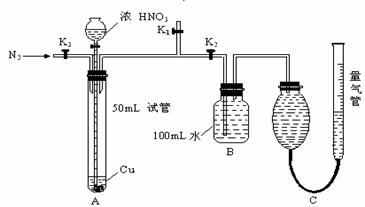 (12分)某学生设计了以下实验方案,探究铜和一定量(10mL)浓HNO3反应中是否产生NO气体,实验装置如图所示(装置的气密性良好),请回答下列问题:
(12分)某学生设计了以下实验方案,探究铜和一定量(10mL)浓HNO3反应中是否产生NO气体,实验装置如图所示(装置的气密性良好),请回答下列问题:
(1)在反应前通入N2目的是_______________________________________________,进行这步操作时应关闭 而打开 (填K1、K2、K3)。
(2)反应结束后,通过分液漏斗向试管中加40mL蒸馏水,再从B装置所得100mL溶液中取出25.00mL,加2滴酚酞试液,用0.1000mol/L的NaOH溶液滴定,当滴定完成后消耗NaOH溶液18.00mL,则B容器中所得HNO3的物质的量是 ,
(3)用C装置读取排出水的体积时,应注意 、 。
(4)若不考虑实验前后导管中的气体,C装置的气体中至少含N2 mL。若由C装置测得所收集到的气体体积为143.0mL(已折算成标准状况),请你判断铜和一定量浓HNO3反应过程中是否有NO生成?如果有,写出判断的依据;如果没有,写出理由。
。
28.(12分)(I)下列实验操作或对实验事实的叙述不正确的是 (填序号)
① 用pH试纸鉴别浓硫酸与浓硝酸
② 用硝酸银溶液区分二氧化氮和溴蒸气
③ 酒精灯碰倒洒出酒精着火,迅速用湿抹布扑盖
④ 用酸性高锰酸钾溶液除去二氧化碳中混有的少量二氧化硫
⑤ 温度计摔坏导致水银散落到地面上,应立即用水冲洗水银
⑥ 称量NaOH固体时,把NaOH固体放在有滤纸的托盘上称量
⑦ 为了提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液进行酸化
⑧ 检验氯代烃中的氯元素时,可先加氢氧化钠溶液,再加入硝酸银溶液来进行检验。
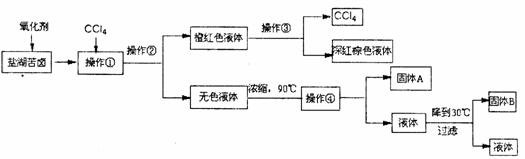 (II)柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源。液体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
(II)柴达木盆地以青藏高原“聚宝盆”之誉蜚声海内外,它有富足得令人惊讶的盐矿资源。液体矿床以钾矿为主,伴生着镁、溴等多种矿产。某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
请根据以上流程,回答相关问题:
 (1)操作①的名称:_____________;操作②名称是:_________;
(1)操作①的名称:_____________;操作②名称是:_________;
操作④需要的玻璃仪器有:___________________。
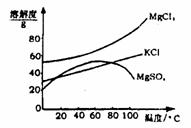
(2)参照右图溶解度曲线,欲得到较纯的氯化钾晶体需
用少量的_______________(选填:“热水”,“冷水”)
洗涤固体______________(选填“A”或“B”)。
27.(6分)有一无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的许多种组成,取该溶液进行如下实验:
①取适量溶液,加入过量盐酸,有气体生成,并得到溶液。
②在①所得溶液中再加入过量的碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲。
③在②所得溶液中加入过量浓Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是
(2)一定存在的离子是
(3)判断沉淀乙成分的方法是
26.(8分)已知某饱和NaCl溶液的体积为VmL,密度为ρg·cm-3,质量分数为w %,物质的量浓度为c mol·L-1 ,溶液中含NaCl的质量为m g
(1)用m、V 表示溶液溶质的物质的量浓度:
。
(2)用w、ρ表示溶液溶质的物质的量浓度:

(3)用c、ρ表示溶液溶质的质量分数:
。
(4)用w表示该温度下NaCl的溶解度:
。
25. 如果
如果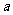 g某气体中含有的分子数为
g某气体中含有的分子数为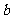 ,则
,则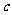 g该气体在标准状况下占有的体积应表示为(式中 为阿伏加德罗常数)
g该气体在标准状况下占有的体积应表示为(式中 为阿伏加德罗常数)
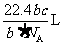
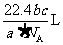
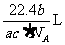
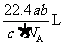 A. B. C. D.
A. B. C. D.

24.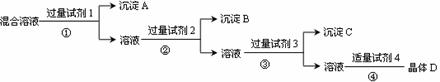 现有含NaCl、Na2SO4和NaNO3的混合溶液,采用下列实验流程加入适当的试剂将其转化为相应的沉淀或固体,实现Cl-、SO42-和NO3-的相互分离:
现有含NaCl、Na2SO4和NaNO3的混合溶液,采用下列实验流程加入适当的试剂将其转化为相应的沉淀或固体,实现Cl-、SO42-和NO3-的相互分离:
其中试剂1、2、4分别为
A.氯化钡溶液 硝酸银溶液 硝酸溶液 B.氯化钡溶液 硝酸溶液 硝酸银溶液 
C.NaOH 溶液 硝酸银溶液 硝酸溶液 D.硝酸银溶液 硝酸钡溶液 硝酸溶液
23.甲、乙两种化合物都只含X、Y 两种元素,甲、乙中 X 元素的百分含量分别为 30.4% 和 25.9%。若已知甲的分子式是 XY2,则乙的分子式只可能是
A.XY B.X2Y C.X2Y3 D.X2Y5
22.下表中实验操作能达到实验目的的是 
|
选项 |
实验操作 |
实验目的 |
|
A |
向甲酸钠溶液中加新制的Cu(OH)2并加热 |
确定甲酸钠中含有醛基 |
|
B |
未知溶液中加盐酸酸化的Ba(NO3)2溶液 |
确定溶液中一定有SO42- |
|
C |
向酒精和醋酸的混合溶液中加入金属钠 |
确定酒精中混有醋酸 |
|
D |
将溴乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 |
检验水解产物中的溴离子 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com