
26、(1)配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+= __CO2+__Mn2++__H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由__变为__。该溶液中还原剂的物质的量为___mol。
③原试样中H2C2O4·2H2O的质量分数为___。KHC2O4的质量分数为___。
广元中学2010届高三第三次月考
25.(10分) A-J分别代表中学化学中常见的一种单质或化合物,其转化关系如图。

已知A在工业上常用作耐火材料,C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态;形成D的元素的原子最外层电子数是次外层的3倍;B在焰色反应中呈紫色(透过蓝色钴玻璃),L是目前应用最广泛的金属。请回答下列问题:
(1)若K为红棕色粉末,写出C与K反应的化学方程式____________________________,引发该反应的操作为_____________________________________________________
__________________________________________________________。
(2)写出电解E水溶液的化学方程式__________________________________________。
(3)J与H反应的离子方程式为_________________________________。若在上述转化关系中每一步反应均为恰好反应,且不考虑C+K→A+L的变化时,为了最终得到J,则A、B的物质的量之比为_____________。
24.(12分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
|
阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
|
阴离子 |
OH-、C1-、CO32-、NO3-、SO42- |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀; C只能与D反应产生沉淀。
试回答下列问题:
(1) 写出化学式:A___________ B___________ D_________
(2) E溶液呈酸性的原因是:(用离子方程式表示)_______________________________
(3 ) 将C溶液逐滴加入等体积、等物质的量浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(4 )在100mL0.1mol·L-1 E溶液中,逐滴加入35mL 2mol·L-1NaOH溶液,最终得到沉淀物质的量为 mol
23.某同学在配制NaOH溶液时有以下现象发生,则对所配溶液的物质的量浓度有何影响?(填偏高、偏低或不变)
(1)定容时仰视 .
(2)NaOH颗粒表面部分变质 .
(3)未将烧杯的洗液注入容量瓶 .
(4)用胶头滴管向容量瓶中加水时凹面高于刻度线.此时立即用胶头滴管将瓶内液体吸出,使凹液面与刻度线相切 .
(5)容量瓶未干燥 .
22.在淀粉-碘化钾溶液中加入少量的次氯酸钠溶液,加入少量的稀硫酸,溶液立即变蓝。有关反应的离子方程式是______________________________________;在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失,有关反应的离子方程式是_____________________从以上的事实可知,ClO-,I2 , SO42-的氧化性由弱到强的顺序是______________________。
21.已知下列两个热化学方程式;
H2(g)+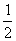 O2(g)===H2O(1);△H=-285.0kJ/mol
O2(g)===H2O(1);△H=-285.0kJ/mol
C3H8(g)+5O2(g)===3CO2(g)+4H2O(1);△H=-2220.0kJ/mol
⑴实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混合气体中H2和C3H8的体积比是 。
⑵已知:H2O(1)=H2O(g);△H=+44.0kJ/mol,写出丙烷燃烧生成CO2和气态水的热化学方程式。
20. 在25℃时,将两个铂电极插入一定量的饱和Na2SO4溶液中进行电解,通电一段时间后在阳极逸出a摩气体,同时析出w克Na2SO4·10H2O晶体,若温度不变,此时剩余溶液的质量分数是
A  ×100% B
×100% B 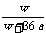 ×100% C
×100% C 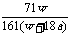 ×100% D
×100% D  ×100%
×100%
19.
Cl2通入一定量浓KOH溶液中,完全参与反应后经测定体积分数为a的氯气被氧化。若溶液中含有Cl―、ClO―、ClO ,且c(Cl―)与c(ClO
,且c(Cl―)与c(ClO )之比为6:1,则a为
)之比为6:1,则a为
A.0.25 B.0.50 C.0.75 D.0.80
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com