
1.下列实验方案合理的是 ( )
A.混有乙酸、乙醇杂质的乙酸乙酯用饱和碳酸钠溶液进行除杂
B. 用加入浓溴水的方法分离苯和苯酚的混合物
C.用点燃的方法除去二氧化碳中混有的少量一氧化碳
D.用热的氧化铜除去氮气中的少量氧气
4、气-气混合分离型:洗气,包括(1)采用液体净化剂时--用洗气瓶;
(2)采用固体净化剂时--用干燥管或反应管。
此外,还应注意一些关联的提法,比如“盐析后过滤”,“加热蒸发”、“萃取分液”“重
结晶过滤”“蒸发结晶”等。物质的分离和提纯常用方法如下表:
|
|
分离和提纯方法 |
适用范围 |
举例 |
|
物 理 方 法 |
过滤法 |
固体与液体分离 |
粗盐的提纯 |
|
蒸发浓缩法 |
分离溶于溶剂中的溶质 |
食盐溶液中的NaCl |
|
|
结晶、重结晶法 |
混合物在溶剂中的溶解度随温度变化不同 |
NaCl和KNO3混合物分离 |
|
|
蒸馏、分馏法 |
沸点不同的液体分离 |
乙醇和乙酸,石油分离 |
|
|
分液法 |
两种互不相溶的液体 |
苯和水 |
|
|
浮选法 |
密度不同且均不溶于水的固体 |
用水在沙里淘金 |
|
|
萃取法 |
某物质在两种互不相溶的溶剂中溶解度不同 |
用CCl4从溴水中提取溴 |
|
|
升华法 |
混合物中某一成分在一定温度下可直接由固体 变为气体,冷却后,气体又直接变为固体。 |
碘和NaCl混合物中提取碘 |
|
|
液化法 |
气体混合物各组分沸点不同,先使其液化后, 控制温度再汽化。 |
从空气中分离N2、O2 |
|
|
渗析法 |
用半透膜使离子或小分子从胶体溶液中分离。 |
把KI从淀粉溶液中分离出来 |
|
|
盐析法 |
加入无机盐,使某些物质溶解度降低而沉淀。 |
从肥皂液中分离甘油;蛋白质盐析 |
|
|
化 学 方 法 |
热分解法 |
混合物各组分的热稳定性不同,加热或灼烧可分 |
除去Na2CO3中的NaHCO3 |
|
处理法 |
混合物各组分的酸、碱性不同,用酸或碱处理 |
分离Fe2O3和Al2O3 |
|
|
沉淀法 |
混合物中某一成分与某试剂反应而沉淀。 |
KNO3中含有KCl即可加入 Ag NO3,使Cl-沉淀除去。 |
|
|
氧化还原法 |
利用混合物中某一成分能被氧化(或被还原) 的性质分离。 |
除去苯中的甲苯,加入酸性KMnO4,甲苯被氧化除去。 |
|
|
电解法 |
利用电解分离和提纯。 |
电解法精练铜。 |
|
|
离子交换法 |
利用离子交换法提纯。 |
离子交换法软化硬水。 |
|
|
络合法 |
混合物中某一组分可形成络合物。 |
分离Al2O3和ZnO |
常见的物质除杂
|
序号 |
原物 |
所含杂质 |
除杂质试剂 |
除杂质的方法 |
|
1 |
N2 |
O2 |
|
|
|
2 |
CO2 |
H2S |
|
|
|
3 |
CO |
CO2 |
|
|
|
4 |
CO2 |
HCl |
|
|
|
5 |
H2S |
HCl |
|
|
|
6 |
SO2 |
HCl |
|
|
|
7 |
Cl2 |
HCl |
|
|
|
8 |
CO2 |
SO2 |
|
|
|
9 |
碳粉 |
MnO2 |
|
|
|
10 |
MnO2 |
碳粉 |
|
|
|
11 |
碳粉 |
CuO |
|
|
|
12 |
Al2O3 |
Fe2O3 |
|
|
|
13 |
Fe2O3 |
Al2O3 |
|
|
|
14 |
Al2O3 |
SiO2 |
|
|
|
15 |
SiO2 |
ZnO |
|
|
|
16 |
CuO |
ZnO |
|
|
|
17 |
BaSO4 |
BaCO3 |
|
|
|
18 |
NaOH |
Na2CO3 |
|
|
|
19 |
NaHCO3 |
Na2CO3 |
|
|
|
20 |
Na2CO3 |
NaHCO3 |
|
|
|
21 |
NaCl |
NaHCO3 |
|
|
|
22 |
NH4Cl |
(NH4)2SO4 |
|
|
|
23 |
FeCl3 |
FeCl2 |
|
|
|
24 |
FeCl3 |
CuCl2 |
|
|
|
25 |
FeCl2 |
FeCl3 |
|
|
|
26 |
Fe(OH)3胶体 |
FeCl3 |
|
|
|
27 |
CuS |
FeS |
|
|
|
28 |
I2 |
NaCl |
|
|
|
29 |
NaCl |
NH4Cl |
|
|
|
30 |
KNO3 |
NaCl |
|
|
|
31 |
乙烯 |
SO2、H2O |
|
|
|
32 |
乙烷 |
乙烯 |
|
|
|
33 |
溴苯 |
溴 |
|
|
|
34 |
硝基苯 |
NO2 |
|
|
|
35 |
甲苯 |
苯酚 |
|
|
|
36 |
乙醛 |
乙酸 |
|
|
|
37 |
乙醇 |
水 |
|
|
|
38 |
苯酚 |
苯 |
|
|
|
39 |
乙酸乙酯 |
乙酸 |
|
|
|
40 |
溴乙烷 |
乙醇 |
|
|
|
41 |
肥皂 |
甘油 |
|
|
|
42 |
葡萄糖 |
淀粉 |
|
|
(此42项答案在《中学常见有颜色的物质归纳》专题下面)
[例1]用Na2CO3、BaCl2和HCl溶液作试剂,除去NaCl溶液中含有的少量Ca2+和SO42-。每种试剂不得重复两次,不得遗留任何其它离子。(1)写出加入试剂的顺序。(2)写出各步反应的离子方程式。(上海考题)
[例2]怎样将氯化铝溶液和氯化铁混合溶液分离?(要求写出实验步骤及有关的离子方程式。)
答:(1)向混合溶液中加入过量的NaOH溶液. (2)过滤。
(3)把Fe(OH)3沉淀洗涤后加入盐酸,到沉淀完全溶解得到FeCl3。
(4)取滤液,通入过量CO2(或加入适量的盐酸),到Al(OH)3沉淀完全为止。
(5)再过滤,沉淀经洗涤后,再用盐酸溶解得到AlCl3溶液。
[例3]有一种工业废水,已知其中含有多量FeSO4,少量Ag+、Hg2+和Na+,以及部分污泥。试设计一个既经济又合理的方法以回收金属银和硫酸亚铁晶体,分别列出实验步骤,说明每一个步骤的目的(不必化学方程式),并指出哪一步对环境有污染。(湖北省竞赛题)
答:①过滤除去污泥。②在滤液中加入过量铁粉,使Ag+、Hg2+还原为Ag和Hg。
③过滤,将Ag和Hg和过量铁粉从溶液中分离出来。
④将混有铁粉的Ag和Hg用稀硫酸处理,使铁溶解。⑤过滤分离出银和汞。
⑥加热Ag和Hg的混合物,这时汞变成汞蒸气挥发而得到银。但汞蒸气会污染环境,应连接冷凝装置。
⑦将第③和第⑤步的滤液合并,蒸发浓缩,冷却,使硫酸亚铁结晶析出。
⑧过滤,得硫酸亚铁晶体,Na+留在母液中。
物质的分离和提纯专项训练题
3、液-液混合分离型:萃取、分液、蒸馏、渗析;
2、固-液混合分离型:过滤、盐析、蒸发;
1、固-固混合分离型:加热(包括灼烧、热分解和升华)、结晶(重结晶);
16.[解析]
(1)设t1、t2为声源S发出的两个信号的时刻,t1′、t2′为观察者接收到两个信号的时刻,则第一个信号经过(t1′-t1)时间被观察者A接收到,第二个信号经过(t2′-t2)时间被观察者A接收到.且
t2-t1=Δt t2′-t1′=Δt′
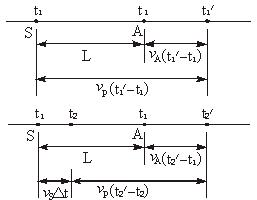
设声源发出第一个信号时,S、A两点间的距离为L,两个声信号从声源传播到观察者的过程中,它们运动的距离关系如图所示.可得
vP(t1′-t1)=L+vA(t1′-t1)
vP(t2′-t2)=L+vA(t2′-t1)-vSΔt
由以上各式,得Δt′= Δt
Δt
(2)设声源发出声波的振动周期为T,这样,由以上结论,观察者接收到的声波振动的周期T′为T′= T
T
由此可得,观察者接收到的声波频率与声源发出声波频率间的关系为
f′= f
f
15.[答案]BC
[解析]该时刻a质点振动最弱,b、c质点振动最强,这不难理解。但是d既不是波峰和波峰叠加,又不是波谷和波谷叠加,如何判定其振动强弱?这就要用到充要条件:“到两波源的路程之差是波长的整数倍”时振动最强,从图中可以看出,d是S1、S2连线的中垂线上的一点,到S1、S2的距离相等,所以必然为振动最强点。
 描述振动强弱的物理量是振幅,而振幅不是位移。每个质点在振动过程中的位移是在不断改变的,但振幅是保持不变的,所以振动最强的点无论处于波峰还是波谷,振动始终是最强的。
描述振动强弱的物理量是振幅,而振幅不是位移。每个质点在振动过程中的位移是在不断改变的,但振幅是保持不变的,所以振动最强的点无论处于波峰还是波谷,振动始终是最强的。
14.[答案]A
[解析]波源S在振动的过程之中要形成分别向左右传播的两列波,波形应如图37所示,故可得到“P在波峰,Q在波谷”,而应选A。
13.[答案]ABD
[解析]
(1)从图33上可以看出波长为4m,选A。
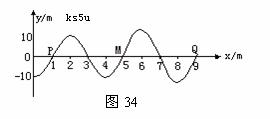 (2)实际上“相继出现两个波峰”应理解为,出现第一波峰与出现第二个波峰之间的时间间隔。
(2)实际上“相继出现两个波峰”应理解为,出现第一波峰与出现第二个波峰之间的时间间隔。 因为在一个周期内,质点完成一次全振动,而一次全振动应表现为“相继出现两个波峰”,即T=0.4s。则V=λ/T=10m/s,所以B选项正确。
因为在一个周期内,质点完成一次全振动,而一次全振动应表现为“相继出现两个波峰”,即T=0.4s。则V=λ/T=10m/s,所以B选项正确。
(3)质点Q(x=9m)经过0.4s开始振动,而波是沿x轴正方向传播,即介质中的每一个质点都被它左侧的质点所带动,从波向前传播的波形图34可以看出,0.4s波传到Q时,其左侧质点在它下方,所以Q点在0.5s时处于波谷。再经过0.2ss即总共经过0.7s才第一次到达波峰,所以选项C错了。
(4)从波的向前传播原理可以知道,M以后的每个质点都是先向下振动的。所以选项D是对的。
12.[答案]C
[解析]λ=24 m,t=(n+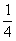 )T=0.2 s
)T=0.2 s
T= (n=0,1,2,……),f=
(n=0,1,2,……),f=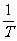 =
= (n=0,1,2,……)
(n=0,1,2,……)
故C项正确.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com