
9.
在一定温度下的定容密闭容器中,当下列物理量不再变化时,能表明反应:
A(s)+2B(g) 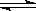 C(g)+D(g)已达平衡的是,
A.混合气体的压强 B.混合气体的密度 C.A的颜色 D.2V(B)正=V(C)逆
C(g)+D(g)已达平衡的是,
A.混合气体的压强 B.混合气体的密度 C.A的颜色 D.2V(B)正=V(C)逆
8. 碰撞理论是一种较直观的反应速率理论,下列有关碰撞理论叙述正确的是 A.增大反应物浓度可以增加活化分子百分数,从而提高有效碰撞几率 B.在一定温度下,同种分子的能量都相同 C.活化分子的碰撞一定就是有效碰撞 D.催化剂可以改变反应的活化能,从而提高有效碰撞几率
7. 用3g块状大理石与30mL3mol/L盐酸反应制取CO2气体,若要增大反应速率且不影响CO2气体的量,可以采用的措施是: ①再加入30mL3mol/L盐酸 ②改用30mL6mol/L盐酸 ③改用3g粉末状大理石 ④适当升高温度
A.①④ B.②③④ C.③④ D.①③④
6.
一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)  Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
A.以X浓度变化表示的反应速率为0.001 mol/(L·s)
B.将容器体积变为20 L,Z的平衡浓度变为0.015mol/L
C.若增大压强,平衡向正方向移动,平衡常熟变大
D.若升高温度,X的体积分数增大,则该反应的DH>0
5. 碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:WI2(g) W(s)+I2(g)ΔH>0。下列说法正确的是
W(s)+I2(g)ΔH>0。下列说法正确的是
A.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W重新沉积到灯丝上
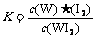 B.灯丝附近温度越高,WI2(g)的转化率越低
B.灯丝附近温度越高,WI2(g)的转化率越低
C.该反应的平衡常数表达式是
D.灯内温度升高时,压强不会变
4.
对于反应2SO2(g)+O2(g) 2SO3(g)能增大正反应速率的措施是
2SO3(g)能增大正反应速率的措施是
A.通入大量O2 B.增大容器容积 C.移去部分SO3 D.降低体系温度
3.
工业制备纯硅的反应:SiCl4(g)+2H2(g) Si(s)+4HCl(g);△H=QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是
Si(s)+4HCl(g);△H=QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C. 反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应
2. 化学反应中通常伴随着能量变化,下列说法中错误的是 A.煤燃烧时将部分化学能转化为热能 B.电解熔融Al2O3时将部分化学能转化为电能 C.TNT爆炸时将部分化学能转化为动能 D.镁条燃烧时将部分化学能转化为光能
1. 下列反应中生成物总能量高于反应物总能量的是 A.碳酸钙受热分解 B.乙醇燃烧
C.铝粉与氧化铁粉末反应 D.氧化钙溶于水
2.尽管重化工业的环境污染比较严重,但是却能为工业化的发展提供坚实的基础,因此成为发达工业的象征。日本、韩国的经济发展都经历了由轻工业(劳动密集型)到重化工业(资源密集型和资金密集型)到高科技工业(技术密集型)的阶段。
(1)为什么日本、韩国在重点发展重化工业之前,要先发展劳动密集型工业?
点拨:重化工业的发展一方面需要有一定的工业基础和技术工人,另一方面需要投入大量的资金,先发展劳动密集型工业有利于利用劳动力资源丰富且廉价的优势,积累资金和造就产业工人。所以,劳动力丰富的发展中国家或地区的工业化往往从优先发展劳动密集型工业开始。
(2)目前,有人提出我国的珠江三角洲地区、东北地区以及浙江省要大力发展重化工业。对此,提出你的看法。
[点拨]珠江三角洲和浙江省经济实力强,有发展资金密集型的重化工业的经济基础,而东北地区则有发展重化工业的工业基础。但是,重化工业的发展需要有严格的环境评价,避免产生严重的环境污染。本问题鼓励学生展开讨论,不必强求答案一致。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com