
4.下列各细胞结构中,可能存在碱基互补配对现象的有( )
①染色体 ②中心体 ③纺锤体 ④核糖体
A.①② B.①④
C.②③ D.③④
3.叶绿体的DNA能指导自身小部分蛋白质在叶绿体内的合成。下列叙述中错误的是( )
A.叶绿体DNA能够转录 B.叶绿体DNA是遗传物质
C.叶绿体内存在核糖体 D.叶绿体功能不受细胞核调控
2.DNA分子中脱氧核苷酸的排列顺序,一般不影响( )
A.DNA的种类的 B.蛋白质的种类
C.有关RNA的种类 D.碱基对的配对方式
1.一杂合体植株(二倍体)的下列部分,经组织培养和秋水仙素处理后可获得纯合体的是( )
A.根 B.茎 C.叶 D.花粉
21.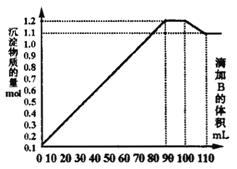 (10分)向100mLBaCl2、AlCl3和FeCl3的
(10分)向100mLBaCl2、AlCl3和FeCl3的
混合溶液A中,逐滴加入Na2SO4和NaOH
的混合溶液B,产生的沉淀总物质的量和加
入溶液B的体积关系如右图所示:
(1)当加入B溶液110 mL时,溶液中的
沉淀是_______ _______(填化学式)。
(2)溶液B中Na2SO4与NaOH的物质的
量浓度之比____________;从90 mL至
100 mL之间加入10 mL B溶液时所发生
的离子反应方程式是________ _。
(3)将A.B溶液中各溶质的物质的量浓度填入下表:
|
溶质 |
Na2SO4 |
NaOH |
BaCl2 |
AlCl3 |
FeCl3 |
浓度 |
|
|
|
|
|
20.(12分)下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问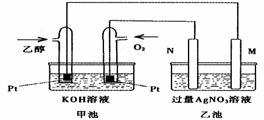 题:
题:
(1)M电极的材料是 ,电极名称是 ,N的电极反应式为
,加入乙醇的铂电极的电极反应式为 。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为
L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的pH为 。
(3)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为 。
19.(14分)Ⅰ. 玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,一般不需要使用玻璃棒进行操作的是(填字母代号)
A. 配制一定溶质质量分数的溶液
B.用pH试纸测定NH4Cl溶液的pH
C.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
D. 实验室用FeSO4溶液和NaOH溶液制备Fe(OH)2沉淀
E. 用已知浓度的盐酸和未知浓度的氢氧化钠溶液进行中和滴定实验
F. 硫酸铜晶体里结晶水含量测定的实验
G. 将适量氯化铁饱和溶液滴入沸水中制氢氧化铁胶体
H. 用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
I. 探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
Ⅱ.食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
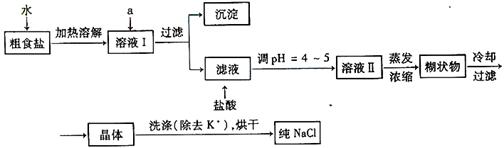
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、 BaCl2溶液、 Ba(NO3)2溶液、75%乙醇、 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为 (只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为 。
(2)用提纯的NaCl配制500mL4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有_________________ (填仪器名称)。
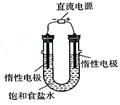 (3)电解饱和食盐水的装置如图所示,若收集的H2为2L,
(3)电解饱和食盐水的装置如图所示,若收集的H2为2L,
则同样条件下收集的Cl2 (填“>”、“=”或
“<”)2L,原因是 。
装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为 。
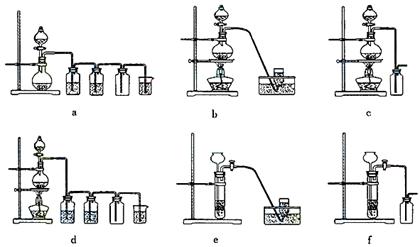
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4==ZnSO4+H2↑
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置 (填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。可选用制备气体的装置:
18.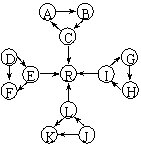 (10分)某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):
(10分)某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):
已知:①图中每个小三角形的三种物质中至少含有一种相同元素,K与L含有完全相同的元素。②D、J为固体单质,R为气体单质,其余物质为常见化合物。③A能使品红溶液褪色,也能使澄清石灰水变浑浊。④E为淡黄色化合物,E与C或L反应都能生成R。⑤I为氧化物,I与F或C都能反应;G和L反应生成难溶物H,H具有较强的吸附性。根据以上信息,回答下列问题:
(1)写出下列反应的化学方程式:
①C→A:
②L→R: 。
(2)写出下列反应的离子方程式:①E→F:
②I→G: 。
(3)常温下,测得一定浓度G溶液的pH=10,试用离子方程式表示其原因:
。
17. (6分)一澄清透明的溶液中可能含有下列离子:K+、Fe3+、Ba2+、Al3+、NH4+、
(6分)一澄清透明的溶液中可能含有下列离子:K+、Fe3+、Ba2+、Al3+、NH4+、
Cl-、I-、NO3-、HCO3-、SO32-、SO42-中的一种或几种,现做以下实验:
 (1)将溶液滴在蓝色石蕊试纸上,试纸呈红色
(1)将溶液滴在蓝色石蕊试纸上,试纸呈红色
 (2)取少量溶液,加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀
(2)取少量溶液,加入用稀硝酸酸化的BaCl2溶液,产生白色沉淀
 (3)将(2)的沉淀过滤。由滤液中加入硝酸银溶液,产生白色沉淀
(3)将(2)的沉淀过滤。由滤液中加入硝酸银溶液,产生白色沉淀
 (4)另取溶液,逐滴加入氢氧化钠溶液至过量,只观察到有红褐色沉淀生成,且沉淀量不减少。由此可以推断:
(4)另取溶液,逐滴加入氢氧化钠溶液至过量,只观察到有红褐色沉淀生成,且沉淀量不减少。由此可以推断:
 溶液中肯定存在的离子有:______________________________________。
溶液中肯定存在的离子有:______________________________________。
 溶液中肯定不存在的离子有:____________________________________。
溶液中肯定不存在的离子有:____________________________________。
 溶液中还不能确定是否存在的离子有:______________________________。
溶液中还不能确定是否存在的离子有:______________________________。
16.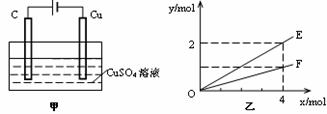 按图甲装置进行实验,实验结果如图乙所示。乙中横坐标x表示电路中通过电子的物质的量,纵坐标y表示反应物或生成物的物质的量,下列叙述不正确的是
( )
按图甲装置进行实验,实验结果如图乙所示。乙中横坐标x表示电路中通过电子的物质的量,纵坐标y表示反应物或生成物的物质的量,下列叙述不正确的是
( )
A.E表示反应生成铜的物质的量 B.E表示反应消耗水的物质的量
C.F表示反应生成氧气的物质的量 D.F表示反应生成硫酸的物质的量
第Ⅱ卷 非选择题(共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com