
2.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。
⑴反应的热化学方程式为
⑵双已知H2O(液)=H2O(气)-44KJ,则16g液态肼与液态双氧水反应生成液态水时放出的热量是
⑶此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
思维方法: 。
展望高考:
[巩固练习]
课堂反馈
1. 14gFe在Cl2中完全燃烧生成FeCl3固体时,放出101.3KJ热量,写出该反应的热化学方程式: ;
已知:2H2(g)+O2(g)=2H2O(l);ΔH=- 572kJ/mol
2CO(g)+O2(g)=2CO2(g);ΔH=- 565kJ/mol
CH4(g)+2O2(g)=CO(g)+2H2O(l);ΔH=- 890kJ/mol
试填空:⑴燃烧等体积(相同状况下)的H2、CO、CH4,放出的热量由大到小的顺序是: ;⑵燃烧等质量的H2、CO、CH4,放出的热量由小到大的顺序是: 。
思维方法: 。
展望高考:
7.自我练习:
(1)已知标准状况下,1升H2S气体完全燃烧生成液态水时放出
a kJ的热量,请写出硫化氢燃烧热的热化学方程式:
。
(2)1g铁粉在氧气中完全燃烧放出的热量可使10毫升的水的温度升高
Δt℃,已知水的比热容为C kJ/(g•℃),试写出铁粉燃烧反应的热化学反应方程式: 。
[例题解析]
[例1] (1)已知:2H2(g) + O2(g) = 2H2O(g) ;ΔH=- Q1kJ/mol
2H2(g) + O2(g) = 2H2O(l) ;ΔH=- Q2kJ/mol。则Q1与Q2相对大小为__________。
(2)已知:2H2O(g) = 2H2(g) + O2(g) ;ΔH=+Q3kJ/mol,则Q3与Q1或Q2关系为___ __。
(3)已知:Q1= 484,Q2= 572,则蒸发2mol水所需能量为__________。
解题思路: 。
易错点: 。
[例2] 已知:(1)C(s) + O2(g) = CO2(g) ;ΔH=-394 kJ/mol。
(2)2CO(g) + O2(g) = 2CO2(g) ;ΔH=- 566kJ/mol。则反应:
2C(s) + O2(g) = 2CO(g) 的反应热是多少?
解题思路: 。
易错点: 。
[考题再现]
6. 盖斯定律:
(1)概念: 。
(2)含义: 。
5.热化学方程式:
(1)概念: 。
(2)含义: 。
(3)书写规则:① 、② 、
③ 、④ 。
(4)注意点:
①注明在什么温度和压强下进行,若不注明,则代表 ;
②化学计量数代表 ,因而可为分数;
③必须在每种物质化学式后的括号内标明 ;
④在热化学方程式后,注明反应的热效应,即 ,在热化学方程式
和热效应之间用 号隔开。
4.中和热:
(1)概念: 。
(2)注意点:①反应条件 、②生成水的量 、
③为何强调强酸强碱和稀溶液 、
④如何测定中和热 。
2.反应热:
(1)概念: 。
(2)符号: (3)单位: 。
(4)辨析:一般情况下,物质越稳定,具有的能量就越 ;物质越不稳定,具有的能量就越 。如果在一个化学反应中,反应物的总能量大于生成物的总能量,则该反应就是 反应,此时的ΔH 0;反之,则为 反应,此时的ΔH 0。因此:ΔH= 物的总能量- 物的总能量;又知一种物质的键能之和越大越稳定,具有的能量就越低。则:ΔH= 物的键能总和- 物的键能总和。3.燃烧热:
(1)概念: 。
(2)注意点:①燃烧条件 、②可燃物的量 、
③完全燃烧的含义 、④燃烧产物的状态和化合价 。
1.吸热反应与放热反应
(1) 吸热反应:_______________________________________________________________
(2) 放热反应:_______________________________________________________________
(3) 常见的吸、放热反应:①电离过程都是_______热过程;②中和反应都是_____热反应; ③水解反应都是_____热反应;④化合反应多数是______热反应;⑤分解反应多数是_____热反应;⑥以下特例:CO2+C == 2CO ;H2+I2==2HI;N2+O2==2NO;C+H2O==CO+H2都为______热反应。
21、已知
 (1)若
(1)若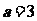 ,
, 为偶函数,
为偶函数, 为奇函数,且
为奇函数,且 ,求
,求 、
、 的解析式
的解析式
(2)若 在
在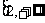 上递增,求实数
上递增,求实数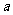 的取值范围
的取值范围

20、已知  是
是 上的奇函数,且当
上的奇函数,且当
(1)求
 的解析式
的解析式
(2)若 在
在 上递增,求实数
上递增,求实数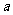 的取值范围
的取值范围
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com