
11.已知298K时反应2SO2( g ) + O2( g )  2SO3( g );△H = -197 kJ·mol-1 ,在相同温度下向一固定体积的密闭容器中加入2 mol SO2和1 molO2 ,达化学平衡时放出热量为a1 kJ ;向同样的另一容器中通入 1 mol SO2和0.5 molO2 ,达化学平衡时放出热量为a2 kJ ,则下列关系式中正确的是( )
2SO3( g );△H = -197 kJ·mol-1 ,在相同温度下向一固定体积的密闭容器中加入2 mol SO2和1 molO2 ,达化学平衡时放出热量为a1 kJ ;向同样的另一容器中通入 1 mol SO2和0.5 molO2 ,达化学平衡时放出热量为a2 kJ ,则下列关系式中正确的是( )
A.2a2 = a1 >197 B.2a2 >a1 >197 C.2a2 <a1< 197 D.2a2 = a1 = 197
10.关于下列图示的说法中正确的是( )
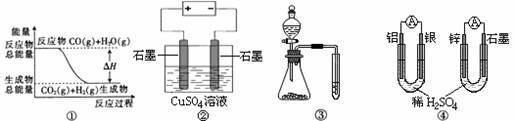

A.图①表示可逆反应“CO(g) + H2O(g) CO2(g)+H2(g)”中的ΔH大于0
CO2(g)+H2(g)”中的ΔH大于0 
B.图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定为1︰1 
C.图③实验装置可完成比较稀硫酸、碳酸、苯酚酸性强弱的实验
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同
9.丁子香酚可做香味剂,萨罗可做消毒剂,二者的结构简式如下图所示,下列说法不正确的是( )


A.萨罗的分子式为C13H10O3 
B.丁子香酚与浓溴水只发生取代反应
C.萨罗和丁子香酚均能发生氧化反应
D.丁子香酚和萨罗均能与氯化铁溶液发生显色反应
8. 一定条件下,体积为2L的密闭容器中,1mol A和1mol B进行反应:
一定条件下,体积为2L的密闭容器中,1mol A和1mol B进行反应:
A(g) + 3B(g)  2C(g) 经2分钟反应达到平衡,此时生成0.2mol C。
2C(g) 经2分钟反应达到平衡,此时生成0.2mol C。
下列说法正确的是( )
A.反应开始至2分钟时,以B浓度变化表示的反应速率为0.05mol/(L×min)
B.反应开始至2分钟时,A的转化率为5%
C.若其他条件不变,升高温度,A的体积分数增大,则该反应的△H<0
D.若其他条件不变,增大压强,化学反应速率的变化符合右侧示意图
7.已知可用Co2O3代替MnO2制备Cl2,反应前后存在六种微粒:Co2O3﹑H2O﹑Cl2、H+ 、Cl-和Co2+ 。下列叙述不正确的是( )
A.氧化产物为Cl2
B.氧化剂与还原剂的物质的量之比为1∶6
C.若有3mol H2O生成,则反应中有2mol电子转移
D.微粒的还原性 Cl->Co2+ 
6.下列反应的离子方程式中正确的是( )学
A.甲醇、氧气和氢氧化钾溶液组成的燃料电池的负极反应
CH3OH+H2O-6e-= CO2↑+6H+
B.在NaHSO4溶液中加Ba(OH)2溶液至中性
H++SO42-+Ba2++OH-= BaSO4↓+H2O
C.NaHSO3溶液与稀硝酸反应:
HSO3-+H+=SO2↑+H2O

D.向偏铝酸钠溶液中加入少量的NaHSO4溶液
AlO2- + H+ + H2O
=== Al(OH)3↓

5.NA代表阿伏加德罗常数,下列有关叙述正确的是( )学
A.1mol Fe3+完全转化成Fe(OH)3胶粒后,Fe(OH)3胶粒数为NA个
B.标准状况下22.4L SO3含有的分子数为NA
C.6gSiO2晶体中含有的硅氧键数目为0.4NA
D.用Pt做电极电解硝酸铜溶液,当阳极产生的气体在标况下为22.4L,转移电子数目为2NA
4.下列各组离子在指定溶液中,不能大量共存的是( )学
A.无色溶液中Na+、Mg2+、NO3-、Cl-
B.使石蕊变红的溶液中Fe3+、NO3-、Na+、SO42- 
C.加入Mg能放出H2的溶液中NH4+、Cl-、K+、SO42-
D.水电离的c(H+)=10-12mol/L的溶液中Na+、Fe2+、Cl-、NO3-
3.下列实验操作或方法中,正确的是(
)
A.用酒精萃取碘水中的碘
B.在容量瓶中溶解氢氧化钠固体 
C.用加热的方法分离氯化钠和氯化铵固体
D.用溶解、过滤的方法除去粗盐中的氯化钙和氯化镁等杂质
2.下列关于化工生产原理的叙述中,正确的是( )学科
A.氯碱工业中,电解槽的阳极区产生NaOH
B.硫酸工业中,接触室的温度选择在400-500℃是为了提高SO2的转化率
C.合成氨工业中,由于氨易液化,N2、H2循环使用,所以总体上氨的产率很高
D.二氧化硫在接触室被氧化成三氧化硫,三氧化硫在吸收塔内被水吸收制成浓硫酸
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com