
3.(04广东-26)孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:
xCuCO3·yCu(OH)2(x、y为正整数且 )
)
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石耗用的盐酸的物质的量与生成的CO2的物质的量之比为4:1;石青则为3:1。请推算它们的化学组成。
孔雀石: ;石青: 。
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO23.36L(标准状况下);加热另一份样品使其完全分解,得到CuO 20g,试通过计算确定该混合物中孔雀石和石青的物质的量之比。
思维方法: 。
展望高考:
[巩固练习]
课堂反馈
2.(04广东-20).海水的综合利用可以制备金属镁,其流程如下图所示:

(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式。

用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是
(2)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。
(3)实验室里将粗盐制成精盐的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的;
溶解时: 。过滤时: 。蒸发时: 。
思维方法: 。
展望高考:
1.(02测试15).铁是自然界分布最广的金属元素之一,在地壳中的质量约占5%左右。铁矿石的种类很多,重要的有磁铁矿石(主要成分是Fe3O4)、赤铁矿石(主要成分是Fe2O3)等。
(1)写出赤铁矿炼铁的主要化学方程式: ;
(2)红热的铁能跟水蒸气反应,有一种产物是可燃性气体,则其反应式为: ;
在常温下,铁跟水不起反应。但是,在水和空气里的氧气及二氧化碳等的共同作用下,铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。刷油漆是重要的防腐蚀措施之一,油漆防腐蚀的主要原理是 。
(3)铁元素是人体的重要营养元素,举一例说明铁元素在人体中的重要作用: 。
思维方法: 。
展望高考:
2.金属冶炼的常见方法
(1) 热分解法:
请写出中学化学中常见的用此法制取某些金属的化学方程式
(2) 热还原法:
对于多数金属的冶炼,常用的还原剂如焦碳、一氧化碳、氢气和活泼金属加热反应的方法。如:
Fe2O3 + C =
CuO + CO =
WO3 + H2 =
MnO2 + Al =
(3) 电解法:
在金属活动顺序表中, 等金属的还原性很强,这些金属都很容易失电子,因此不能用一般的方法和还原剂使其从化合物中还原出来,只能用电解其 和 的方法来冶炼.如(请用相关的化学方程式举例:说明)
[例题解析]
[例1](02春招-31)Fe是地壳中含量很丰富的元素,也是生物体所必需的元素。
(1)自然界中铁矿石主要有赤铁矿和磁铁矿,金属铁是在高炉中冶炼的,高炉炼铁除了加入铁矿石外,还需加入焦炭和石灰石。请填空:
①写出磁铁矿主要成分的化学式: 。
②写出赤铁矿被还原成铁的化学方程式: 。
③写出焦炭在高炉中参与反应的两个化学方程式: 。
④写出CaCO3所参与反应的两个化学方程式: 。
解题思路: 。
易错点: 。
[例2](01上海-31).已知Fe2O3在高炉中有下列反应
Fe2O3+CO→2FeO+CO2
反应形成的固体混和物(Fe2O3、FeO)中,元素铁和氧的质量比用mFe︰mO表示。
(1)上述固体混和物中,mFe︰mO不可能是 (选填 a、b、c多选扣分)
(a)21︰9 (b)21︰7.5 (c) 21︰6
(2)若mFe︰mO=21︰8,计算Fe2O3被CO还原的百分率
(3)设 Fe2O3被CO还原的百分率为A%,则A%和混和物中mFe︰mO的关系式为(用含mFe、mO的代数式表示)。
 A%=
A%=
请在下图中画出A%和mFe/mO关系的图形。
(4)如果 Fe2O3和CO的反应分两步进行:
3Fe2O3+CO→2Fe3O4+CO2
Fe3O4+CO→3FeO+CO2
试分析反应形成的固体混和物可能的组成及相应的mFe︰mO(令mFe︰mO=21︰a,写出a的取值范围)。将结果填入下表。
|
混和物组成(用化学式表示) |
a的取值范围 |
|
|
|
解题思路: 。
易错点: 。
[考题再现]
1.金属在自然界存在有 态也有 态,
(1) 你能否给金属的冶炼下一个定义?
(2) 金属冶炼的原理是什么?
(3) 金属冶炼一般要经过那几个步骤?
(4) 金属冶炼有哪些方法?金属活动顺序与金属冶炼方法有没有联
系呢?如果有,有什么规律吗?
金属冶炼的一般规律:
K Ca Na Mg Al
( )法
Zn Fe Sn Pb (H) Cu
( )法
Hg Ag Pt Au
( )法 ( )取法
(5)在热还原法中还原剂通常是与金属氧化物反应,如果矿石不是氧化物而
是硫化物或碳酸盐时,怎么办?
(6)焦炭和氢气作为还原剂有什么区别(优缺点),如果要冶炼纯度很高的
金属一般要选用什么还原剂?用Al作为还原剂一般用于冶炼哪些金属?

3. 常识性了解金属回收与环境资源保护的意义;能写出冶炼金属
方法中对应的常见金属冶炼的有关化学发方程式.

教与学方案 笔记与反思
[自学反馈]
2.了解金属冶炼的一般原理及步骤,记住金属冶炼的三种方法,即热分解法、
热还原法和电解法;
1. 常识性了解金属在自然界中的分布、存在形态以及储量;
1、下列灭火剂能用于扑灭金属钠着火的是 A、干冰灭火剂 B、黄砂 C、干粉(含NaHCO3)灭火剂 D、泡沫灭火剂 2.用铜锌合金制成的假金元宝欺骗行人的事件屡有发生。下列不易区别其真伪的方法是 A、测定密度 B、放入硝酸中 C、放入盐酸中 D、观察外观 3、下列叙述中,正确的是 A、含金属元素的离子不一定都是阳离子 B、在氧化还原反应中,非金属单质一定是氧化剂 C、某元素从化合态变为游离态时,该元素一定被还原 D、金属阳离子被还原不一定得到金属单质 4、关于晶体的下列说法正确的是 A、在晶体中只要有阴离子就一定有阳离子 B、在晶体中只要有阳离子就一定有阴离子 C、原子晶体的熔点一定比金属晶体的高 D、分子晶体的熔点一定比金属晶体的低 5、已知铍(Be)的原子序数为4.下列对铍及其化合物的叙述中,正确的是 A、铍的原子半径大于硼的原子半径 B、氯化铍分子中铍原子的最外层电子数是8 C、氢氧化铍的碱性比氢氧化钙的弱 D、单质铍跟冷水反应产生氢气 6、制印刷电路时常用氯化铁溶液作为“腐蚀液”:发生的反应为2FeCl3+Cu=2FeCl2+CuCl2,向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是 A、烧杯中有铜无铁 B、烧杯中有铁无铜 C、烧杯中铁、铜都有 D、烧杯中铁、铜都无 7、将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是 A、硫酸 B、氯水 C、硝酸锌 D、氯化铜 8、由锌、铁、铝、镁四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是 A、锌 B、铁 C、铝 D、镁 9、把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为a g,则原合金中铁的质量分数为 A、70% B、52.4% C、47.6% D、30% 10、将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是 A、3摩/升HCl B、4摩/升HNO3 C、8摩/升NaOH D、18摩/升H2SO4 11、某二价金属碳酸盐和碳酸氢盐的混合物跟足量盐酸反应,消耗H+和产生CO2的物质的量之比为6:5,该混合物中碳酸盐和碳酸氢盐的物质的量之比为 A、1:1 B、1:2 C、1:3 D、1:4 12、铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为 A、9.02g B、8.51g C、8.26g D、7.04g
课外作业
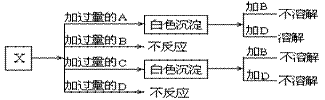
13、A、B、C和D分别是NaNO3、NaOH、HNO3和Ba(NO3)2四种溶液中的一种。现利用另一种溶液X,用如下图所示的方法,即可将它们一一确定。试确定A、B、C、D、X各代表何种溶液。
A:_______ B:_______ C:_______ D:_______ X:_______
 14、试样X由氧化亚铁和氧化铜组成.取质量相等的两份试样按下图所示进行实验:
14、试样X由氧化亚铁和氧化铜组成.取质量相等的两份试样按下图所示进行实验:
 (1)请写出步骤③中所发生的全部反应的离子方程式.
(2)若全部的溶液Y和全部的粉末Z充分反应后,生成的不溶物W的质量是m,则每份试样X中氧化铜的质量为_____________.(用m表示)
15、现有一定量含有Na2O杂质的Na2O2试样.请从下图中选用适当 应物只有CaCO3固体,6摩尔/升,盐酸和蒸馏水).
(1)请写出步骤③中所发生的全部反应的离子方程式.
(2)若全部的溶液Y和全部的粉末Z充分反应后,生成的不溶物W的质量是m,则每份试样X中氧化铜的质量为_____________.(用m表示)
15、现有一定量含有Na2O杂质的Na2O2试样.请从下图中选用适当 应物只有CaCO3固体,6摩尔/升,盐酸和蒸馏水).
 请填写下列空白:
(1)写出实验中Na2O2和Na2O分别发生反应的化学方程式______________。
(2)应选用的装置是(只要求写出图中装置的标号)______________________。
请填写下列空白:
(1)写出实验中Na2O2和Na2O分别发生反应的化学方程式______________。
(2)应选用的装置是(只要求写出图中装置的标号)______________________。
(3)所选用装置的连接顺序应是(填各接口的字母;连接胶管省略)_________。 16、取一定量的Na2CO3、NaHCO3和Na2SO4混合物与250mL 1.00mol·L-1过量盐酸反应,生成2.016L CO2(标准状况),然后加入500mL 0.100mol·L-1Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL 1.00ml·L-1盐酸恰好完全中和。计算混合物中各物质的质量。
2.性能:
[例题解析]
例1、下列有关金属元素特征的叙述正确的是 A、金属元素的原子只有还原性,离子只有氧化性 B、金属元素在化合物中一定显正价 C、金属元素在不同化合物中的化合价均不同 D、金属元素的单质在常温下均为金属晶体 解题思路: 。
易错点: 。 例2、A、B、C三种金属相对原子质量之比为3:5:7,若以4:2:1的原子
个数比形成三种金属组成的混合物4.64g,溶于足量的盐酸后,放出氢气在标准状
况下的体积是3. 136L,若三种金属均为正2价,求三种金属的相对原子质量。
解题思路: 。
易错点: 。
例3、下列各图中的纵坐标表示沉淀的物质的量,横坐标表示加入x的物质的量,请将各图一一对应的反应的代号填入每图下方的括号内。

 A、Ca3(PO4)2悬浊液中滴入H3PO4 B、NaAlO2溶液中通入HCl
C、Ba(OH)2溶液中通入SO2
D、石灰水中通入CO2
E、AlCl3溶液中滴入氨水
F、AlCl3溶液中滴入NaAlO2溶液
G、SO2溶液中通入H2S气体 H、稀硫酸中滴入Ba(OH)2溶液
I、AlCl3、MgSO4的混合溶液中加入过量NaOH溶液
J、在盐酸酸化的AlCl3溶液中,滴入KOH溶液 K、AlCl3溶液中滴入NaOH溶液
解题思路: 。
A、Ca3(PO4)2悬浊液中滴入H3PO4 B、NaAlO2溶液中通入HCl
C、Ba(OH)2溶液中通入SO2
D、石灰水中通入CO2
E、AlCl3溶液中滴入氨水
F、AlCl3溶液中滴入NaAlO2溶液
G、SO2溶液中通入H2S气体 H、稀硫酸中滴入Ba(OH)2溶液
I、AlCl3、MgSO4的混合溶液中加入过量NaOH溶液
J、在盐酸酸化的AlCl3溶液中,滴入KOH溶液 K、AlCl3溶液中滴入NaOH溶液
解题思路: 。
易错点: 。
例4、把铁粉、铜粉放入稀硝酸溶液中充分反应后 ①若铁有剩余,则溶液中存在的物质是( )②若铜有剩余,则溶液中存在的物质是( ) A、Cu(NO3)2 Fe(NO3)2 B、Cu(NO3)2 HNO3 C、Fe(NO3)2 D、Fe(NO3)3
解题思路: 。
易错点: 。 例5、某碱金属M及其氧化物(M2O)组成的混和物13.3g,加足量水充分反应后的溶液经蒸发结晶,得干燥固体16.8g,求该混和物的成分及其质量。 解题思路: 。
易错点: 。 例6、14g铁粉全部溶于稀HNO3溶液中,恰好反应,放出NO气体后得到溶液1L,称量所得溶液,发现比原稀HNO3增重8g。求 ① 所得溶液中金属离子的物质的量浓度。② 原稀HNO3溶液的物质的量浓度(体积变化忽略不计)。 解题思路: 。
易错点: 。
[考题再现]
 1、用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不合Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入_________。
(2)除去蒸馏水中溶解的O2常采用_________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不合O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_________。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管I里加入的试剂是_________。
(2)在试管Ⅱ里加入的试剂是_________。
(3)为了制得白色Fe(OH)2沉淀,在试管I和Ⅱ中加入试剂,打开止水央,塞紧塞子后的实验步骤是_________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理出是_________。
1、用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不合Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入_________。
(2)除去蒸馏水中溶解的O2常采用_________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不合O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是_________。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管I里加入的试剂是_________。
(2)在试管Ⅱ里加入的试剂是_________。
(3)为了制得白色Fe(OH)2沉淀,在试管I和Ⅱ中加入试剂,打开止水央,塞紧塞子后的实验步骤是_________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理出是_________。
思维方法: 。
[巩固练习]
课堂反馈
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com