
3.下列叙述正确的是( )
A.同主族金属的原子半径越大熔点越高
B.稀有气体的原子序数越大沸点越高
C.分子间作用力越弱分子晶体的熔点越低
D.同周期元素的原子半径越小越易失电子
2.下列各组物质熔点的比较,正确的是( )
A.金刚石>硫 B.NaCl>金刚石 C. D.
D.
1.下列微粒在固态时形成分子晶体的是( )
A.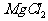 B.
B.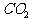 C.NaOH D.He
C.NaOH D.He
2. (2004,上海10)有关晶体的下列说法正确的是( )
A. 晶体中分子间作用力越大,分子越稳定
B. 原子晶体中共价键越强,分子越稳定
C. 冰熔化时水分子中的共价键发生断裂
D.氯化钠熔化时离子键未被破坏
[巩固练习]
课堂反馈
[例题解析]
[例1] 在白磷分子中,每个磷原子以________键与另外的________个磷原子相结合成________结构,键角为________。如果把一个白磷分子的每个P-P都打开插入一个氧原子,则一共可结合_________个氧原子,这样得到化合物的分子式为________。
解题思路: 。
易错点: 。
[例2] 已知有关物质的熔、沸点数据如下表:
|
|
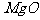 |
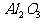 |
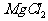 |
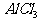 |
|
熔点/℃ |
2852 |
2072 |
714 |
190(2.5× Pa) Pa) |
|
沸点/℃ |
3600 |
2980 |
1412 |
182.7 |
请参考上述数据填空并回答问题:
工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁;也不用电解AlCl3的方法生产铝?答:_______________________________。
解题思路: 。
易错点: 。
[考题再现]
1. 已知C3N4晶体很可能具有比金刚石更大的硬度,且原子间均以单键结合。下列关于C3N4晶体的说法正确的是( )
A.C3N4晶体是分子晶体
B.C3N4晶体中,C-N键的键长比金刚石中的C-C键的键长要长
C.晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D.C3N4晶体中微粒间通过离子键结合
思维方法: 。
展望高考: 。
3.分子晶体:CO2晶体:在一个晶胞中含有 个CO2分子,与一个CO2分子距离最近且等距离的CO2分子有 个。白磷分子与甲烷分子都是正四面体结构,它们在结构上的区别是 。
2.原子晶体:
(1)金刚石:一个C原子周围以共价键同时结合 个C原子,键角为 ,形成正四面体结构,并不断向周围扩展成空间网状结构。
(2)石墨(过渡晶体)一个C原子周围以共价键同时结合 个C原子,键角为形成 结构,并不断向周围扩展成 结构,金刚石不导电而石墨导电的原因是 ,金刚石硬而石墨软的原因是 ,石墨的熔点高于金刚石而沸点与金刚石相同的原因是 。
(3)硅晶体:与 相似,只需将其中的 原子换成 原子,键长变得稍 一些即可。
(4)碳化硅晶体:与 相似,只需将其中的 原子用 原子和 原子交替更换,键长介于 和 之间即可,其熔沸点比金刚石的 ,比硅晶体的 。
(5)二氧化硅晶体结构能用类似方法模拟来吗?在1molSiO2晶体中含有 mol的Si-O键。
1. 离子晶体:
(1)NaCl:一个Na+周围以离子键同时结合 个Cl-,与一个Na+距离最近
的Na+有 个,在一个晶胞中含Na+、Cl-分别为 、 个,若NaCl晶胞
的边长为r cm,阿伏加德罗常数为NA,则晶体的密度为 。
(2)CsCl:一个Cs+周围以离子键同时结合 个Cl-,与一个Cs+距离最近
的Cs+有 个,在一个晶胞中含Cs+、Cl-分别为 、 个,若CsCl晶胞的
边长为r cm,晶体的密度为dg/cm3,则阿伏加德罗常数为 。
4.金属晶体:
(1)概念: 。
(2)性质特征: 。
(3)重要判断依据: 。
(4)影响熔沸点高低的因素: 。
3.分子晶体:
(1)概念: 。
(2)性质特征: 。
(3)重要判断依据: 。
(4)影响熔沸点高低的因素: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com