
6、当c点的区时为6月22日4时时,此刻全球以哪两条经线为界分属两个日期
A、20°W和160°E B、120°E和180°
C、160°E和180° D、60°W和180°
中国第22次南极科考队乘“雪龙”号科考船于2005年12月18日到达中山站,12月24日从中山站出发前往格罗夫山考察。除完成各项科学考察任务外,此次考察将为我国在南极大陆建立第三个考察站做前期准备工作。读下图,完成7-8题。

5、当北京时间是5月1日8时时,上图中哪一点的区时刚好是4月30日20时
A、a B、b C、c D、d
4.当南京地区的人们观看日全食现象时,纽约时间(西五区)约是 ( )
A.7月22日22时 B.7月21日14时
C.7月22日20时 D.7月21日20时
读下图中的四图幅经伟网图回答5-6题。

3. 日食发生时,是观察太阳外部结构的有利时机。在下列天文现象中,最有利于观察的是
A.太阳黑子 B.耀斑 C.日珥 D.太阳风
2.在下列城市中,最先看到食甚现象的是
A.上海 B.成都
C.武汉 D.北京
1.日全食发生的条件是
A.月球位于太阳与地球之间(新月)时,
太阳、月球、地球的中心在同一直线上
B.地球位于太阳与月球之间(满月)时,
太阳、月球、地球的中心在同一直线上
C.太阳、月球、地球成直角(上弦月)时
D.太阳、月球、地球成直角(下弦月)时
22.(8分)高铁酸钾(K2FeO4)具有极高的氧化性,对环境无不良影响,被人们称为“绿色化学”试剂。某校化学兴趣小组对高铁酸钾进行了如下探究。
I、高铁酸钾制备:
①在一定温度下,将氯气通入KOH溶液中制得次氯酸钾溶液;②在剧烈搅拌条件下,将Fe(NO3)3 分批加入次氯酸钾溶液中,控制反应温度,以免次氯酸钾分解;③加 KOH至饱和,使K2FeO4 充分析出,再经纯化得产品。
温度过高会导致次氯酸钾分解生成两种化合物,产物之一是氯酸钾(KClO3),此反应化学方程式是 。
II、探究高铁酸钾的某种性质:
[实验1]:将适量K2FeO4分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度均为 1.0mmol·L-1(1mmol·L-1=10-3mol·L-1)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800min后,三种溶液中高铁酸钾的浓度不再改变)。

[实验2]:将适量 K2FeO4 溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为 1.0mmol·L-1 的试样,将试样分别置于 20℃、30℃、40℃和 60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。
(1)实验1的目的是 ;
(2)实验2可得出的结论是 ;
(3)高铁酸钾在水中的反应为4
FeO42-+10 H2O 4
Fe(OH)3 +8OH-+3 O2↑。
4
Fe(OH)3 +8OH-+3 O2↑。
由图1可知,800min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是 ;
湖南师大附中高三第2次月考试题
20.(7分)将表面被氧化的铝片投入浓氯化铜溶液中,铝片表面很快出现一层海绵状暗红色物质,接下来铝片上又产生大量气泡。触摸容器壁和溶液温度迅速升高,收集气体,检验其具有可燃性。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不发生反应的原因可能是( )
A.氯化铜溶液的酸性比同浓度的硫酸铜溶液强
B.硫酸铜溶液水解产生的硫酸使铝钝化
C.氯离子能破坏氧化铝薄膜而硫酸根离子不能
D.生成的氯化铝能溶于水,而生成的硫酸铝难溶于水
(2)铝片表面出现的暗红色物质是 ,产生该物质的离子方程式是 。
(3)放出的气体是 ,请分析开始阶段产生气体的速率不断加快的原因是: ① ②
(4)某学生通过一定的实验操作,使表面氧化的铝片与硫酸铜溶液的反应也能较快进行,他采取的措施可能是( )
A.用砂纸擦去铝表面的氧化膜后投入硫酸铜溶液中
B.把铝放在氢氧化钠溶液中加热一段时间后,取出洗净,投入硫酸铜溶液中
C.向硫酸铜溶液中加入少量氢氧化钠溶液,再投入铝片
D.在铝片上捆上几枚铜钉后投入同浓度的硫酸铜溶液中
21(8分)实验室欲用下列装置和药品来制备少量的氮化镁(已知氮化镁容易与水反应)
上图的实验装置中,A中是浓氨水,B中是生石灰,C中是干燥剂。已知氨气有还原性,能还原氧化铜,生成物之一是空气的主要成分。试通过分析回答:
(1)装置B中生石灰的作用是 ;
(2)装置C中应当选用的干燥剂是 ;
(3)装置E的作用是 ;
(4)如果没有装置F,可能发生的反应 。
18.(10分)中学化学中几种常见物质的转化关系如下:
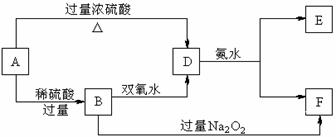
已知A→D的反应必须加热,否则会发生钝化现象。请回答下列问题:
(1)B、D、E的化学式依次为 、 、 。
(2)写出B的酸性溶液与双氧水反应的离子方程式: 。
(3)写出B和过量过氧化钠反应生成F的化学方程式
19(8分).某无色溶液由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种组成。取该溶液进行如下实验:
(A)取试液适量,加入过量稀盐酸,有气体生成,得到溶液甲;
(B)向溶液甲中再加入过量碳酸氢铵溶液,有气体生成,析出白色沉淀乙,得到溶液丙;
(C)向溶液丙中加入过量Ba(OH)2溶液,有气体生成,析出白色沉淀丁。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是 。
(2)一定存在的离子是 。
(3)生成沉淀乙的离子反应方程式是 。
(4)写出步骤(C)中产生气体的离子方程式 。
17.(9分)某强酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒:O2 、MnO4-、H2O 、Mn2+ 、H2O2 、H+ 。已知该反应中H2O2 只发生了如下过程:H2O2 →O2。
(1)该反应体系选择的酸是: (填序号)。
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸。
(2)写出该反应的离子方程式:
。
(3)如果上述反应中有6.72L(标准状况.)气体生成,转移的电子数为 mol。
(4)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN + H2O2+H2O = A + NH3↑,试指出生成物A的化学式为 ,并阐明H2O2被称为绿色氧化剂的理由是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com