
2.设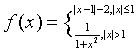 ,则
,则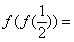 (
)
(
)
A. B.
B. C.
C.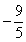 D
.
D
.
1.若集合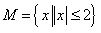 ,
,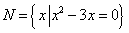 ,则M∩N= (
)
,则M∩N= (
)
A. B.
B.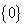 C.
C.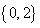 D.
D.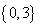
18.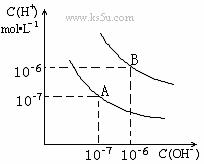 水的电离平衡曲线如图所示:
水的电离平衡曲线如图所示:
(1)若以A点表示25℃时水的电离平衡时的离子
浓度,当温度升高到100℃时,水的电离平衡
状态到B点,则此时水的离子积从
增加到 。
(2)将pH= 8的Ba(OH)2溶液与pH=5的稀盐酸混合,
并保持100℃的恒温,致使混合溶液的pH=7,
则Ba(OH)2溶液与盐酸的体积比为
17、(2005梅州)A、B两种物质都是由氢、氮、氧、钠四种元素中的任意三种组成,它们的水溶液分别呈碱性和酸性。在相同温度下,A溶液的pH大于相同物质的量浓度的B溶液的pH(溶液浓度不小于10-5 mol•L-1),请找出A与B可能有的两种组合,并且要求当这两种组合中的A溶液的pH相等时,第一种组合的A溶液中水的电离程度小于第二种组合的A溶液中水的电离程度;当这两种组合中的B溶液的pH相等时,第一种组合的B溶液中水的电离程度小于第二种组合的B溶液中水的电离程度
(1)写出可能有的两种组合中A与B的名称:
第一种组合:A ,B ;
第二种组合:A ,B ;
(2)说明pH相等时,第一种组合的B溶液中水的电离程度比第二种组合的B溶液中水的电离程度小的原因:
16、0.5 mol•L-1一元弱酸A和未知浓度的一元强碱B以1:2体积比混合,所得溶液的
[OH-]=0.1 mol•L-1,用B中和20mL一元弱酸C(该酸溶液[H+]= 0.01 mol•L-1),当恰好完全反应时,用去5mLB溶液。求弱酸C的电离度
15、弱碱AOH的电离度为α,在含有n molAOH的水溶液中,未电离的分子和阴、阳离子总
数 是阿伏加德罗常数的 倍
14、若室温时pH=a 的氨水与pH=b的盐酸等体积混合,恰好完全反应,则该氨水的电离度可表示为( )
A.10 a+b-12% B.10 a+b-14% C.1012- a-b % D.1014- a-b %
13.常温下某溶液由水电离产生c(H+)=1×10-13mol/L,满足此条件的溶液中一定可以大量共存的离子组是
A.K+ NH Cl- NO
Cl- NO B.K+ Na+ Cl- SO
B.K+ Na+ Cl- SO
C.Na+ Al3+ Cl- NO D.K+ Na+ Cl- CO
D.K+ Na+ Cl- CO
12.对于25℃时,pH都等于4的盐酸和碘化铵溶液中,水的离子积(KW)和电离度(盐 酸
和碘化铵中分别用αA和αB表示)的有关叙述正确的是
A.KW不等,αA=αB B. KW相等,αA=10-5αB
C. KW相等,αB=106αA D. KW不等, B=106αA
11.若室温时0.1mol/L的盐NaR的溶液的PH=10,0.1mol/L的酸HR的溶液PH=3,则两种溶液中水的电离度的比值是
A.1:104 B.1:1 C.1:10-7 D.无法确定
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com