
9.4
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 ;
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3 ;
8.9
8.5
8.4
8.3
23.(12分)
温度(℃)
10
20
30
50
70
pH
 ①从反应开始到平衡,氢气的平均反应速率v(H2)=_______________________;
①从反应开始到平衡,氢气的平均反应速率v(H2)=_______________________;
②该反应的平衡常数K为
(精确到小数点后两位)。若提高温度到
③平衡时CH3OH的体积分数ω为 ;
④若在相同条件下,起始时加入物质的量为:a mol CO2、bmol H2 和c molCH3OH、c mol H2O,达平衡后,CH3OH的体积分数仍为ω。则a、b、c的关系为 。
⑵在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2 CO2=2 CO+O2,CO可用作燃料。
已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O
则阴极反应式为________________________________。
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
△H=-49.0kJ/mol
CH3OH(g)+H2O(g)
△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
22.(12分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为
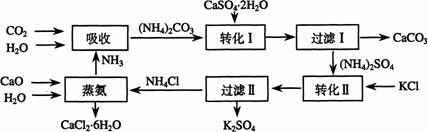
(1)本工艺中所用的原料除CaSO4?2H2O、(NH4)2CO3外,还需要___________等原料;
(2)石膏悬浊液中加入碳酸铵溶液后反应的化学方程式为______________________;
(3)过滤Ⅰ操作所得固体有______________________(填化学式)等物质,该固体可用作生产水泥的原料;
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有NH4+的方法是:____________________________________________________________________;
(5)氯化钙结晶水合物(CaCl2?6H2O)是目前常用的无机储热材料,选择的依据除熔点较低和熔化的热效应高外,还因为其______________________,举出该晶体的无水物在实验室的一种用途 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com