
1.阳离子的检验:
|
离子 |
检验试剂 |
实验现象 |
离子方程式 |
|
H+ |
石蕊试液 |
溶液变红 |
|
|
Na+ |
焰色反应 |
火焰呈黄色 |
|
|
Fe2+ |
①NaOH溶液 ②KSCN溶液、氯水 ③K3[Fe(CN)3]溶液 |
①先生成白色沉淀,很快变为灰绿色,最后变为红褐色 ②加KSCN溶液不变色,加氯水后便红色 ③生成蓝色沉淀 |
①Fe2++2OH-=Fe(OH)2↓ 4Fe(OH)2+2H2O+O2=4Fe(OH)3 ②2Fe2++Cl2=2Fe3++2Cl- Fe3++SCN-=[Fe(SCN)]2+ |
|
Fe3+ |
①NaOH溶液 ②KSCN溶液 |
①出现红褐色沉淀 ②溶液呈血红色 |
①Fe3++3OH-=Fe(OH)3↓ ② Fe3++SCN-=[Fe(SCN)]2+ |
|
Cu2+ |
NaOH溶液 |
蓝色沉淀 |
Cu2++2OH-=Cu(OH)2↓ |
|
NH4+ |
与NaOH溶液混合加热,产生使湿润的红色石蕊试纸变蓝的气体 |
无色有刺激性气味的气体,试纸变蓝 |
NH4++OH- △ NH3↑+H2O |
|
Mg2+ |
加过量NaOH溶液 |
有白色沉淀生成 |
Mg2++2OH-=Mg(OH)2↓ |
|
Al3+ |
NaOH溶液,氨水 |
生成的白色沉淀,继续加NaOH溶液,沉淀溶解;继续加氨水沉淀不溶解 |
Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O |
9.洗气:气体中混有的杂质气体可通过洗气瓶除去,如CO2中混有HCl,可通过饱和NaHCO3溶液洗气。

知识点2、常见离子的检验方法
8.盐析:常见皂化液中分离出肥皂、甘油。
7.渗析:除去胶体中的小分子或离子,如除去Fe(OH)3胶体中的盐酸。
6.萃取:利用溶质在互不相溶的两种液体中溶解度差别很大,进行分离,如用苯或CCl4从溴水中提取溴。
5.固体灼烧:除去固体物质中含有的易升华、易分解物质或除去结晶水合物的结晶水等。如除去Na2CO3溶液中的NaHCO3。
4. 蒸发:加热使溶质从溶液中结晶分离出来,如从NaCl溶液中分离出NaCl。
蒸发:加热使溶质从溶液中结晶分离出来,如从NaCl溶液中分离出NaCl。
较多晶体析出时停止加热,利用余热把剩余水蒸干。
3.蒸馏:根据沸点不同分离互溶的两种液体,如石油的分馏。
 注意事项:需加沸石防止暴沸;温度计的水银球在蒸馏烧瓶的支管口处;冷凝水从冷凝管下口进上口出。
注意事项:需加沸石防止暴沸;温度计的水银球在蒸馏烧瓶的支管口处;冷凝水从冷凝管下口进上口出。
2.分液:分离互不相溶的两种液体(如图2),如水和四氯化碳的分离。
 注意事项:分液漏斗下端紧靠烧杯内壁,打开分液漏斗上口玻璃塞,打开活塞,让下层液体从下面流出到分界面,再关闭活塞,上层液体由上口倒入另一烧杯。
注意事项:分液漏斗下端紧靠烧杯内壁,打开分液漏斗上口玻璃塞,打开活塞,让下层液体从下面流出到分界面,再关闭活塞,上层液体由上口倒入另一烧杯。
萃取剂选择:①、与原溶剂互不相溶、互不反应;②、溶质在萃取剂中溶解度比原溶剂大得多且不反应。
1.过滤:分离固体与液体互不相溶的混合物,如除去NaCl溶液中的BaCO3。
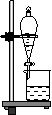 注意事项:“一贴二低三靠” 滤纸紧贴漏斗内壁,滤纸低于漏斗边缘,液面低于滤纸边缘,上烧杯口紧靠玻棒,玻棒末端紧靠三层滤纸处,漏斗末端紧靠下烧杯内壁
注意事项:“一贴二低三靠” 滤纸紧贴漏斗内壁,滤纸低于漏斗边缘,液面低于滤纸边缘,上烧杯口紧靠玻棒,玻棒末端紧靠三层滤纸处,漏斗末端紧靠下烧杯内壁
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com