
19.(12分)
(1)氨基、羧基(苯基写不写均可,但必须写出“氨基”和“羧基”)(每个1分,共2分)
(2) +Cl2光
+Cl2光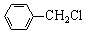 +HCl(2分)
+HCl(2分)
(3)取代(1分) 缩聚 (1分)
(4)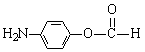 (2分,结构简式写错得0分)
(2分,结构简式写错得0分)
(5)(每步1分,共4分)

(结构简式、反应条件错1个扣1分,扣完为止)
 21B.(12分)
21B.(12分)
(1)驱赶其中溶解的CO2,防止滴定时消耗一定量的NaOH溶液,导致测定结果偏高(2分)
(2)偏高(2分)
(3)C(2分)
(4)② 边加边振荡锥形瓶(2分)
④ 当最后一滴NaOH标准溶液滴入,溶液的颜色由无色突然变为粉红色,且在半分钟内不褪色(2分)
(5)4.795 g/100 mL(2分)
18.(10分)
(1)杀菌消毒、吸附悬浮物(或其他合理答案)(各1分,共2分)
(2)探究温度对FeO42-浓度的影响(或其他合理答案)(1分) >(1分)
(3)C(2分)
(4)① CrO2-+FeO42-+2H2O=Fe(OH)3↓+CrO42-+OH-(2分)
②  (2分)
(2分)
17.(10分)
|
(2)TiO2+2Cl2+2C
TiCl4+2CO(2分)
2Mg(s)+TiCl4(l)=2MgCl2(s)+Ti(s) △H=-512 kJ·mol-1(2分,状态不写得0分)
(3)Mg、Cl2(共2分,各1分)
(4)正(1分) TiO2+4e-=Ti+2O2-(2分)
16.(8分)
(1)Fe(或铁) 稀硫酸(或稀H2SO4) (每空1分,共2分)
(2)冷却结晶 过滤(洗涤干燥)(每空1分,共2分)
(3)使Fe3+形成Fe(OH)3沉淀 防止生成Cu(OH)2沉淀(各1分,共2分,合理答案也给分)
(4)Fe+2Fe3+=3Fe2+(2分)(全卷化学方程式、离子方程式统一评分标准:化学式写错得0分;配平、反应条件、箭号错误共扣1分)
15.(每空2分,共10分)
(1)取少量反应后的混合液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已完全反应;反之,则未完全反应
(2)隔绝空气分离(或其他合理答案)
(3)①250 mL容量瓶、酸式滴定管 ② 95.00% ③样品在空气中被氧化(或样品在空气中吸水)
21. (12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内作答。若两题都做,将按A题评分。
(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内作答。若两题都做,将按A题评分。
A.砷化镓(GaAs)属于第三代半导体,用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。砷化镓的晶胞结构如右图。试回答:
(1)As的核外电子排布式为 ▲ 。
(2)砷化镓晶胞中所包含的Ga原子个数为 ▲ 。
(3)下列说法正确的是 ▲ (填字母)。
A.砷化镓晶胞结构与NaCl相同
B.第一电离能:As>Ga
C.电负性:As>Ga
D.砷化镓晶体中含有配位键
E.半导体GaP与GaAs互为等电子体
(4)砷化镓是将(CH3)3Ga和AsH3用MOCVD方法在700℃时制备得到。AsH3的空间形状为 ▲ ,(CH3)3Ga中镓原子的杂化方式为 ▲ 。
(5)AsH3沸点比NH3低,其主要原因是 ▲ 。
B.食醋是日常饮食中的一种调味剂,对改善食物的口感、增进食欲、促进食物消化等都有独特的功能。利用滴定分析法可以测定食醋总酸含量[食醋总酸含量是指100 mL食醋中含酸(以醋酸计)的质量,也称食醋的酸度。国家标准规定酿造食醋总酸含量不得低于3.5 g/100 mL]。
某研究性学习小组设计并实施的测定食醋总酸含量的实验方案如下:
① 用25 mL移液管移取某品牌的市售食醋25.00 mL,置于250 mL容量瓶中,加水稀释至刻度,摇匀得待测食醋溶液。
② 把0.1000 mol·L-1的标准NaOH溶液装入碱式滴定管。
③ 用25 mL移液管从容量瓶移取待测食醋溶液25.00 mL,置于洗净的锥形瓶中,加入2-3滴指示剂。
④ 用0.1000 mol·L-1的标准NaOH溶液滴定待测食醋溶液至滴定终点。
⑤ 重复上述步骤①-④3次,所得实验数据如下表。
|
实验次数 |
第1次 |
第2次 |
第3次 |
第4次 |
|
待测食醋的体积 V[CH3COOH(aq)]/mL |
25.00 |
25.00 |
25.00 |
25.00 |
|
所用0.1000 mol·L-1的标准NaOH溶液的体积 V[NaOH(aq)]/mL |
19.99 |
20.50 |
20.00 |
19.95 |
请回答下列问题:
(1)稀释食醋所用的蒸馏水要经过煮沸处理,其目的是 ▲ 。
(2)若将碱式滴定管洗净后,直接盛装标准NaOH溶液完成后续实验,会导致测定结果:
▲ (填“偏高”、“偏低”或“无影响”)。
(3)本实验中,选择的合适的指示剂可以是 ▲ (填字母)。
A.甲基橙 B.石蕊 C.酚酞
(4)在滴定的过程中,要注意:
① 使滴定管内的标准NaOH溶液滴入锥形瓶中;
② ▲ ;
③ 眼睛注意观察锥形瓶中溶液颜色的变化和加入碱液的速度;
④ 接近终点时应该减慢加入碱液的速度。当 ▲ ,即达到滴定终点。
(5)此研究性学习小组测定的该品牌的食醋总酸含量为 ▲ 。
(本试卷未经授权,不得发表、复制。)
__________学校2010届高三学情分析样题
|
选择题
非选择题
20.(10分)工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化:
2SO2(g)+O2 (g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是 ▲ (填字母)。
A.向装置中充入N2 B.向装置中充入过量的O2
C.使用更高效的催化剂 D.升高温度
(2)在一密闭容器中充入4 mol SO2和一定量O2,当放出353.6 kJ热量时,SO2的转化率最接近于 ▲ (填字母)。
A.40% B.50% C.80% D.90%
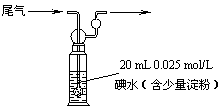 (3)580℃时,在一密闭容器中充入一定量的SO2和O2,当反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3 mol·L-1、8.0×10-3 mol·L-1和4.4×10-2 mol·L-1。该温度下反应2SO2(g)+O2 (g)
(3)580℃时,在一密闭容器中充入一定量的SO2和O2,当反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3 mol·L-1、8.0×10-3 mol·L-1和4.4×10-2 mol·L-1。该温度下反应2SO2(g)+O2 (g) 2SO3(g)的平衡常数K= ▲ 。
2SO3(g)的平衡常数K= ▲ 。
(4)硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需要加以处理后才能排放。现用右图所示装置测定尾气中SO2的含量,当通入尾气11.2 L(标准状况下测定)时,碘水恰好褪色。通过计算说明,该尾气能否直接排放(写出计算过程)。 ▲
19.(12分)化合物C是一种合成药品的中间体,其合成路线为:
|
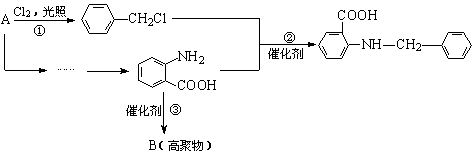
已知:

(1)写出 中官能团的名称 ▲ 。
中官能团的名称 ▲ 。
(2)写出反应①的化学方程式 ▲ 。
(3)反应②属于 ▲ 反应,反应③属于 ▲ (填有机反应类型)。
(4)写出满足下列条件的 的同分异构体的结构简式 ▲ 。
的同分异构体的结构简式 ▲ 。
 ① 苯环上的一取代产物只有两种;
① 苯环上的一取代产物只有两种;
② 具有弱碱性,能发生银镜反应;
 ③ 水解后的产物能与FeCl3溶液发生显色反应。
③ 水解后的产物能与FeCl3溶液发生显色反应。
(5)请你设计由A合成B的合成路线。 ▲
提示:①合成过程中无机试剂任选;②合成路线表示方法示例如下:

18.(10分)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 ▲ 。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ▲ ;发生反应的△H ▲ 0(填“>”、“<”或“=”)。



(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 ▲ (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤3:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤4:加入二苯胺磺酸钠作指示剂,用c mol·L-1 (NH4)2Fe(SO4) 2标准溶液滴定至终点,消耗(NH4)2Fe(SO4) 2溶液V1 mL。滴定时发生的反应为:Fe2++Cr2O72-+H+→Fe3++Cr3++H2O(未配平)
① 写出步骤2中发生反应的离子方程式 ▲ 。
② 根据上述实验数据,测定该溶液中K2FeO4的浓度为 ▲ mol·L-1(用含字母的代数式表示)。
17. (10分)21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
(10分)21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
已知:
① Mg(s)+Cl2 (g)=MgCl2 (s) △H=-641 kJ·mol-1
② Cl2(g)+1/2Ti (s)=1/2TiCl4 (l) △H=-385 kJ·mol-1
(1)钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。TiO2+发生水解的离子方程式为 ▲ 。
 (2)反应Ⅰ在800-900℃下进行,还生成一种可燃性无色气体,该反应的化学方程式为
▲ ;反应Ⅱ的热化学方程式为 ▲ 。
(2)反应Ⅰ在800-900℃下进行,还生成一种可燃性无色气体,该反应的化学方程式为
▲ ;反应Ⅱ的热化学方程式为 ▲ 。
(3)该工艺流程中,可以循环使用的物质有 ▲ 。
(4)在800℃-1000℃时电解TiO2也可制得海绵钛,装置如右图所示。图中b是电源的 ▲ 极,阴极的电极反应式为 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com