
1、石油的炼制 2、乙烯的分子组成和结构 3、乙烯的化学性质
3、化学反应方程式:

若温度过高加热时间过长有如下副反应发生:

本实验只能用无水乙酸钠与碱石灰共热,而不能用 CH3COONa·3H2O的原因是:在反应中若有水存在时,CH3COONa和NaOH会电离,使分子间反应不能发生,因而不能制得CH4。生石灰在本实验中的主要作用是:稀释NaOH,减弱高温下对玻璃的腐蚀,吸收反应物药品中的湿存水。
石油和煤 重要的烃(一)
2、发生装置:固一固反应要加热。
1、药品:无水CH3COONa 和碱石灰。
15、取标准状况下CH4和过量O2的混合气体840 mL,点燃,将燃烧后的气体用过量碱石灰吸收,碱石灰增重0.600 g,计算:
(1)碱石灰吸收后所剩气体的体积(标准状况)。
(2)原混合气体中CH4和O2的体积比。
[答案] 解析:
(1)CH4+2O2

1 mol 80 g
原混合气体中n(CH4)= =0.0075
mol
=0.0075
mol
则V(CH4)=0.0075 mol×22.4×103 mL·mol-1=168 mL
故剩余气体840 mL-3×168 mL=336 mL
(2)V(CH4)∶V(O2)=168 mL∶(840 mL-168 mL) =1∶4
高考解析
例1、目前上海大部分城市居民所使用的燃料主要是管道煤气,浦东新区居民开始使用东海天然气作为民用燃料。管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4。它们的燃烧反应如下:

根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是 ___________。因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是________进风口(填“增大”或“减小”),如不作改进可能产生的不良结果是_____________。
管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:

试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是 __________________________。
解析:由反应方程式可知,燃烧相同体积的管道气和天然气,天然气消耗 O2的体积大。因此,由管道煤气改烧天然气,就必须增大进氧气的量,以保证天然气充分燃烧,以防发生不完全燃烧生成CO,发生一氧化碳中毒。由表中数据知,丁烷沸点为-0.5℃,易液化。在寒冷的冬季,由于温度偏低使丁烷液化,导致管内气流不畅,出现火焰很小且呈断续状态。
答案:天然气;增大;不能充分燃烧,生成有毒的 CO;丁烷遇冷凝结为液体使管道内气流不畅。
例2、利用天然气合成氨的工艺流程示意图如下:

依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是 ________________ 。
(2) n mol CH4 经一次转化后产生 CO 0.9n mol 、产生 H2__________ mol (用含 n 的代数式表示)。
(3) K2CO3 (aq)和 CO2 反应在加压下进行,加压的理论依据是 _________ (多选扣分)。
(a)相似相溶原理 (b)勒沙特列原理 (c)酸碱中和原理
(4)由 KHCO3 分解得到的 CO2 可以用于 _______________ (写出 CO2 的一种重要用途)。
(5)整个流程有三处循环,一是 Fe(OH)3 循环,二是 K2CO3 (aq)循环,请在上述流程图中标出第三处循环(循环方向、循环物质)。
答案:(1)3H2S+2Fe(OH)3=Fe2S3+6H2O
(2)2.7n
(3)b
(4)生产纯碱(或作制冷剂等,其他合理答案也给分)

解析:(1)流程图中已给出反应物是H2S和Fe(OH)3,生成物是Fe2S3和H2O,CH4没有参与反应,写出方程式再配平即可。
(2)写出此反应的方程:CH4+H2O→CO+3H2,很容易地看出产生H2应为3×0.9n mol=2.7n mol。
(3)CO2为气体,加压有利于平衡右移,利用的是勒夏特列原理。
(4)此题考查了考生对CO2用途的记忆,写任一种用途即可。
(5)合成氨反应是一可逆反应,H2和N2的转化率低,必须循环利用
课外拓展
甲烷的实验室制法
14、将75mL的甲烷、氢气和一氧化碳的混合气与200mL氧气混合点燃,经过充分反应并干燥,体积减少100mL,再将剩余气体通过碱液吸收,还有125mL。上述体积均在298K,1.01×105Pa测定。
(1)判断混合气体是否能完全燃烧?
(2)总体积减少100mL后,所得气体是什么?多少毫升?
(3)共生成二氧化碳多少毫升?最后剩余125mL气体是什么?
(4)原混合气体各组分的体积分别是多少毫升?
解析:(1)采用极限法,判断氧气过量即CH4 + 2O2→,2H2 + O2→,2CO+ O2→,所以75mL气体无论是哪一种,氧气都剩余,因而75mL混合物完全燃烧。
(2)燃烧并干燥气体是二氧化碳和剩余氧气,体积等于200+75-10=175mL
(3)因为最后剩余气体是氧气,所以共生成二氧化碳的体积为:175-125=50mL
(4)设原混合气体中甲烷的体积为xmL,氢气的为ymL,一氧化碳的为zmL,
则CH4 + 2O2 = CO2 + 2H2O 2H2 + O2 =2H2O 2CO + O2 = 2CO2
x 2x y 0.5y z 0.5z
依据题意得: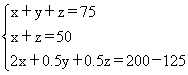
因此x=25mL,y=25mL,z=25mL
13、用系统命名法命名下列化合物:
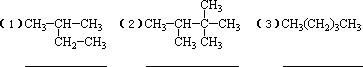

答案:(1)2-甲基丁烷 (2)2、2、3-三甲基丁烷 (3)戊烷 (4)2、3-二甲基丁烷
(5)2、3、4-三甲基-5-乙基庚烷 (6)2、2、4-三甲基-5-乙基辛烷
12、将一支盛满甲烷和氯气的混合气体的试管倒置于盛有饱和食盐水的水槽中,在漫射光的照射下,产生的现象是(1)_____________(2)_____________(3)_____________。
[答案] 解析:光照时,氯气与甲烷反应,使氯气减少,故颜色变浅;反应后气体减少,故液面上升;生成的CH2Cl2、CHCl3、CCl4是难溶于水的液体,故有油状液体生成。
答案: (1)颜色变浅;(2)试管内液面上升;(3)有油状液体生成。
11、甲烷分子的电子式为_____,结构式为_____,分子的空间构型为_____,分子中的键角为_____。
答案: 正四面体 109°28′
正四面体 109°28′
10、将a(O2)、b(CH4)、C(Na2O2)放入密闭容器中,在150℃条件下电火花引发反应,反应后容器中的压强为零,由此作出的正确结论是( )
A.原a、b、c物质的量之比为1:2:6,反应后容器中生成Na2CO3和NaHCO3的混合物
B.原a、b、c物质的量之比为2:1:4,反应后容器中生成Na2CO3和NaOH的混合物
C.原a、b、c物质的量之比为1:2:6,反应后容器中生成Na2CO3和NaOH的混合物
D.原a、b、c物质的量之比为2:1:4,反应后容器中生成NaHCO3和NaOH的混合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com