
3.链霉素能与原核生物核糖体上的S 蛋白结合,从而阻止了基因表达中的翻译过程。现有一种细菌,其S
蛋白结合,从而阻止了基因表达中的翻译过程。现有一种细菌,其S 蛋白上有一个氨基酸种类发生改变,导致S
蛋白上有一个氨基酸种类发生改变,导致S 不能与链霉素结合。以下叙述
不能与链霉素结合。以下叙述
正确的是
A.该细菌内S 蛋白质的空间结构可能发生了改变
蛋白质的空间结构可能发生了改变
B.S 蛋白质变化的原因是因为细菌内tRNA的种类发生了变化
蛋白质变化的原因是因为细菌内tRNA的种类发生了变化
C.链霉素是抗此种细菌的特效药
D.S 蛋白中氨基酸的改变是链霉素长期作用的结果
蛋白中氨基酸的改变是链霉素长期作用的结果
2.下列有关微生物的叙述中,正确的是
①酵母菌 ②乳酸菌 ③硝化细菌 ④蓝藻
⑤SARS病毒 ⑥噬菌体
A.从结构和成分看,③④⑥是原核生物,⑤的遗传物质中不含胞嘧啶
B.从新陈代谢类型看,②⑤是厌氧型,⑤的遗传物质中不含胞嘧啶
C.从生殖方式看,①能进行有性生殖和出芽生殖,②③④⑥能进行分裂生殖
D.从生态系统中的成分看,①②属于分解者,③④属于生产者
1. 下图①、②、③、④依次表示:内分泌腺与靶细胞的关系、有丝分裂末期和四分体时期的三个重要数值的相对量、C3和C4植物在不同CO2浓度下的光合作用强度、组成细胞的主要元素的相对含量,其中有错误的是
下图①、②、③、④依次表示:内分泌腺与靶细胞的关系、有丝分裂末期和四分体时期的三个重要数值的相对量、C3和C4植物在不同CO2浓度下的光合作用强度、组成细胞的主要元素的相对含量,其中有错误的是
A.①②③ B.①②④ C.②③④ D.①③④
25.计算题(本题共11分)
已知:工业制硝酸涉及下列重要的反应:
4NH3+5O2 4NO+6H2O; 4NO+3O2+2H2O
4NO+6H2O; 4NO+3O2+2H2O 4HNO3
4HNO3
设空气中氧气的体积分数为0.20,氮气体积分数为0.80,请完成下列填空及计算:
⑴amol NO完全转化为HNO3需要氧气的物质的量 n(O2)=____________mol;(3分)
⑵现有氨气和空气组成的混合气体,为使NH3和空气中的氧气恰好完全反应生成一氧化氮,则氨气和空气组成的混合气体中氨的体积分数为_________________________(保留2位小数)(4分)
⑶硝酸工业生产中的尾气有NO 和NO2 气体,可用纯碱溶液吸收,有关的化学反应为:
2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2↑ ①
NO + NO2 + Na2CO3 → 2NaNO2 + CO2↑ ②
现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量增加44g。
计算吸收液中NaNO2和NaNO3物质的量之比。(4分)
24.(共18分)氮、磷和砷(As) 三种元素位于同一主族,他们的单质及其化合物有广泛用途。
⑴有关于As的反应中,反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X
①已知KBrO3在反应中得到电子,则该反应的还原剂是 。
②已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为 。
③根据上述反应可推知 。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4> KBrO3 C.还原性:AsH3>X D.还原性:X > AsH3
④将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中:

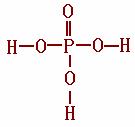
⑵①关于P元素,可以形成多种含氧酸,如磷酸(H3PO4)、亚磷酸(H3PO3)、次磷酸(H3PO2)磷酸结构式见右上图,三聚磷酸可视为三个磷酸分子之间脱去两个分子产
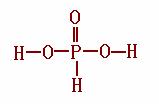 物,其结构式为
。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其
物,其结构式为
。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其
化学式为 。
②已知亚磷酸的化学式为H3PO3、结构式如右下图所示,则H3PO3为__________元酸,Na2HPO3为 盐(填“正盐”或“酸式盐”)
③次磷酸(H3PO2)与NaOH溶液作用形成次磷酸钠,次磷酸钠(NaH2PO2)可用于化学镀镍。NaH2PO2中P元素的化合价为 。
23.(本题共12分)最近出现的婴幼儿奶粉事件查出了不法分子往奶粉里添加三聚氰胺以提高蛋白质含量。
(1)三聚氰胺是一种低毒的化工原料(结构简式如图),结构上可看作是三分子氰胺聚合而成,下列说法正确的是( )
A.三聚氰胺仅由氮、氢两种元素组成 B.三聚氰胺是一种芳香族化合物
C.三聚氰胺的二氯代物有2种 D.氰胺的结构简式为NH2C= N
(2)三聚氰胺也被人称为“蛋白精”,价格便宜。因其中含氮,并且无色无味,被不法商贩用于提高奶粉的含氮量,造成蛋白质含量高的假象。三聚氰胺分子式为_______,其含氮的质量分数为 _______。
 (3)三聚氰胺最早被李比希于1834年合成,早期方法已被淘汰。目前多采用尿素法(NH2)2CO,在催化剂并加热条件下生成三聚氰胺,同时得到氨气和二氧化碳。试写出反应的方程式:____________
(3)三聚氰胺最早被李比希于1834年合成,早期方法已被淘汰。目前多采用尿素法(NH2)2CO,在催化剂并加热条件下生成三聚氰胺,同时得到氨气和二氧化碳。试写出反应的方程式:____________
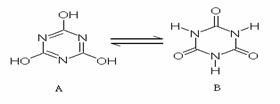
(4)三聚氰胺会水解,胺基(-NH2)逐步被羟基取代,
最后生成三聚氰酸(右图A),A与B的关系如图,
则下列关于A和B的说法中正确的是( )
A.互为同分异构体 B.互为同位素
C.同系物 D.同一种物质
22.(本题共10分)今有一无色透明溶液,只可能含有以下离子中的若干种:K+、H+、Mg2+、Fe3+、Ba2+、SO42-、CO32-、NO3-,现取二份各100 mL溶液进行如下实验:
①第一份加足量NaHCO3 溶液加热后,收集到气体0.04mol
②第二份加足量Ba(NO3)2 溶液充分反应后过滤干燥,得沉淀4.66 g。
根据上述实验回答
⑴溶液中一定不存在的离子是
;⑵溶液中可能存的离子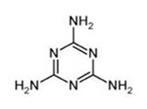 是
;
是
;
⑶写出①发生反应的离子方程式________________________________________________________;
⑷写出②发生反应的离子方程式________________________________________________________;
21.(共9分)用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500ml的操作步骤如下:①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④转移、洗涤 ⑤定容、摇匀 ,请按要求填空:
(1)如果实验室有10mL、20mL、50mL量筒,应选用 mL量筒最好。
(2)第⑤步实验的操作是(文字叙述)_______________________________________________
(3)某学生的下列操作中使浓度偏低的是: 。
①用量筒量取浓硫酸时,仰视读数。
②量筒中浓硫酸全部转入烧杯中稀释后,再转移到100ml容量瓶中,烧杯未洗涤。
③用玻璃棒引流,将溶液转移到容量瓶中有溶液流到了容量瓶外面。
④用胶头滴管加蒸馏水时,加入过快而使液面超过了刻度线,立即用滴管吸去多余的水,使溶液凹液面刚好与刻度线相切。
⑤滴加蒸馏水,使溶液凹面刚好与刻度线相切,盖上瓶塞反复摇匀后,静置,发现液面比刻度线低,再加水至刻度线。
⑥溶液定容时,俯视容量瓶刻度环
20.在一定条件下,RO3-与R-发生如下反应:RO3-+5R-+6H+=3R2+3H2O,下列关于R元素的叙述正确的是
A.R位于VA族 B.R2在常温常压下一定是气体
C.RO3-中的R只能被还原 D.R的氢化物的水溶液属于强酸
19.在硫酸铝、硫酸钾和明矾的混合溶液中,SO42-的离子浓度为0.40mol/L,当加入等体积0.40mol/LKOH溶液时,生成的沉淀恰好完全溶解,则反应后溶液中K+的浓度 ( )
A.0.25mol·L-1 B.0.45 mol·L-1 C.0.50 mol·L-1 D.0.90 mol·L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com