
下图为东西两半球的两区域略图。读图完成8-10题。
8、两图中的水域分别是( )
A、咸海、大西洋 B、里海、太平洋
C、黑海、印度洋 D、红海、太平洋
9、有关图A的叙述,正确的是(
A、比例尺大于B图
 B、图示区域气候终年炎热干燥
B、图示区域气候终年炎热干燥
C、②处有重要的地理分界线
D、①处为平原,种植业
10、图B所示地区的自然特点是( )
A、冬温夏凉、四季如春 B、炎热多雨、植被茂盛
C、冬温多雨、夏热干燥 D、炎热干燥、沙漠广布
中哈输油管线(哈萨克斯坦阿塔苏--中国新疆阿拉山口输油管线)已于2004年9月28日动工铺设,管线全长1000千米。结合所学知识回答5-7题。
5、中哈输油管线经过地区的主要生态问题是( )
A、水土流失 B、土壤次生盐渍化
C、土地荒漠化 D、气候变暖
6、目前,我国进口的石油基本来自中东。为了建立多元化的石油进口渠道,从位置方面考虑除了中东外,较为理想的进口石油的地区是( )
①加勒比海地区 ②北非 ③东南亚 ④中亚 ⑤俄罗斯
A、①②③ B、①③⑤ C、②③④ D、③④⑤
7、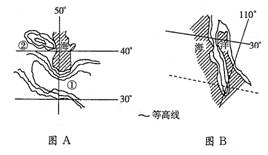 哈萨克斯坦石油最丰富的地区是( )
哈萨克斯坦石油最丰富的地区是( )
A、里海沿岸 B、巴尔喀什湖附近 C、额尔齐斯河沿岸 D、北部丘陵
读下图,回答3-4题。
3、图中甲国是世界上洪涝灾害最严重的国家之一,该国洪涝灾害频繁发生的主要原因有( )
 ①属于热带季风气候区,降水量的季节变化大
①属于热带季风气候区,降水量的季节变化大
②泥沙淤积严重,阻塞河道
③地势低平,排水不畅
④气温高,山地冰川融水量大
A、①④ B、①② C、②③ D、①③
4、关于图中a、b两河的叙述,不正确的是( )
A、两河都是靠高山冰雪融水补给的
 B、两河都属于印度洋水系
B、两河都属于印度洋水系
C、两河共同冲积形成了甲国境内的三角洲
D、b河的水能资料比a河丰富
2005年10月1日当地时间18时50分(东八区)印度尼西亚旅游度假胜地巴厘岛连续发生3次爆炸,造成重大人员伤亡。读图回答1-2题。
1、巴厘岛不具有的旅游自然风光是( )
A、热带雨林葱绿 B、温暖的海水和海浪
C、奇特的火山群 D、蜿蜒曲折的峡湾海岸
2、印尼鼓励A岛向B岛移民,其主要原因不正确的是( )
A、促进B岛经济开发与发展 B、缓解A岛的人口压力
C、实现本国区域经济平衡发展 D、提高B岛人口增长率
1、[命题意图]本题以社会热点问题为载体,考查化学键及分子构型知识。
[思路点拨]添加三聚氰胺能提高奶粉的含氮量水平,从而造成蛋白质含量的虚高。A项错误,三聚氰胺是一种白色结晶粉末,属于分子晶体,熔点较低,硬度小。B项错误,由结构式可知,三聚氰胺属于非极性分子,在水中可形成悬浊液。C项正确。氨基的电子式为 ,D项错误。
,D项错误。
12、(15分)某课外活动小组利用如图所示的装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约l min后鼓入空气。请填写下列空白:

(1)检验乙醛的试剂是 (2分)。
A.银氨溶液 B.碳酸氢钠溶液 C.新制氢氧化铜 D.氧化铜
(2)乙醇发生催化氧化的化学反应方程式为 (2分)。
(3)实验时,常常将甲装置浸在70-80℃的水浴中,目的是
由于装置设计上的缺陷,实验进行时可能会 (每空2分)。
(4)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。试解释鼓气速度过快,反应体系温度反而下降的原因:
该实验中“鼓气速度”这一变量你认为可用
来估量(每空2分)。
(5)该课外活动小组偶然发现向溴水中
加入乙醛溶液,溴水褪色。该同学为解释
上述现象,提出两种猜想:①溴水将乙醛
 氧化为乙酸;②溴水与乙醛发生加成反应。
氧化为乙酸;②溴水与乙醛发生加成反应。
请你设计一个简单的实验,探究哪一种猜
想正确?
(3分)。

11、(14分)已知①
②
有机物A~F中,A与H2加成得到烷烃,经测定,该烷烃分子中只有两个-CH3,其一卤代物有两种同分异构体,C与X反应生成D。各物质之间的转化关系如图所示:

(1)写出X的结构简式: (2分)
(2)写出化合物A、E的结构简式:A: 、E (每空2分)
(3)写下列反应的类型C→D 、E→F (每空1分)
(4)写出B与足量新制氢氧化铜悬浊液共热时发生反应的化学方程式:
(3分)
(5)有机物G是有机物C不同类型的同分异构体,并且G能与金属钠发生应放出无色气体,又能发生银镜反应,又知G的同一类型的同分异构体共有多种,则其中只含有一个甲基的同分异构体的结构简式有:

、 、 (每
空1分)
10、(14分)A、B、C、X是中学化学常见物质,
均由短周期元素组成,转化关系如图所示。请
针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该
元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀
①A中含有的金属元素为 (2分)。
②该金属元素的单质与某氧化物在高温下反应,可用于焊接铁轨及定向爆破,反应的化学反应方程式为 (2分)。
(2)若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8e-结构。
①B的电子式为 (2分)。
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为 (2分)。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①A中所含有的化学键是 、 (每空1分)。
②将4.48 L(标准状况下)X通入100mL 3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为 (2分)。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为
(2分)。
9、(17分)元素X、Y、Z、W均为短周期元素,且原子序数依次增大。已知Y原子最外层电子数占核外电子总数的3/4,W-、Z+、X+半径逐渐减小,化合物XW常温下为气体,Z是本周期中除稀有气体元素外,原子半径最大的元素,据此回答下列问题:
(1)W在元素周期表中的位置: ,工业上生产W单质的离子方程式为: (每空2分)
(2)A、B均为由上述四种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,组成元素的原子数目比均为1:1:1。若A能抑制水的电离,而B能促进水的电离,则A、B的化学式分别为 、 (每空2分)。
(3)C是由上述四种元素的两种组成的一种含有非极性键的离子化合物,则C的电子式为 (2分)。
(4)用B在碱性条件下可以处理CN-的工业废水,请将下列6种微粒:CN-、CO32-、N2、OH-、B的阴离子,W的阴离子,分别填入在下对应的横线上,组成一个配平的离子方程式(7分,每空1分)。
+ + ═ + + + H2O
8、X+、Y+、M2+、N2-是均含若干个电子的短周期元素的简单离子,离子半径大小关系:N2->Y+、Y+> X+、Y+> M2+、M2+> X+,下列比较中正确的是( )
A.原子半径:N可能比Y大,也可能比Y小 B.M2+、N2-核外电子数相等
C.原子系数:N>M>X>Y D.M(OH)2>Y OH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com