
3.球面上有3个点,其中任意两点的球面距离都等于大圆周长的 ,经过这3个点的小圆的周长为4Л,那么这个球的半径为
( )
,经过这3个点的小圆的周长为4Л,那么这个球的半径为
( )
A.4 B.2
B.2 C.2 D.
C.2 D.
2.若球的大圆的面积扩大为原来的3倍,则它的体积扩大为原来的 ( )
A.3倍 B.27倍 C.3 倍 D.
倍 D. 倍
倍
1.① 当平面到球心的距离小于球半径时,球面与平面的交线总是一个圆;
② 过球面上两点只能作一个球大圆; ③ 过空间四点总能作一个球;
④ 球的任意两个大圆的交点的连线是球的直径.以上四个命题中正确的有 ( )
A.0个 B.1个 C.2个 D.3个
知识网络
见上一课时间
学习要求
1、熟练掌握求一般面积与体积的常用方法,2、了解并能运用分割求和的思想。
自学评价
21.(6分)将标准状况下4.48 L的CO2通入200mL的NaOH溶液恰好充分反应后,溶液中生成盐的质量为19.0 g。
(1)反应后生成的盐是(写化学式) 。
(2)200mLNaOH溶液的物质的量浓度为 。
(3)向生成的19.0 g的盐溶液中加入一定量某物质,充分反应后,减压低温蒸发得到纯净的21.2 g Na2CO3固体。则:
①若只能加入0.05 mol某物质,则加入的化合物可以是 。
②若只能加入0.10 mol某物质,则加入的化合物可以是 。
2009-2010学年度十堰市部分重点中学高三年级10月调考
19.(12分)为了研究氯水能否和碳酸钙发生化学反应,某学生设计如下实验:
实验一: 在不加热的情况下用右图装置制取氯气,已知A是HCl, B为固体,则B可能是 (写物质名称,任写一种即可),该反应的化学方程式为:
 实验二:用右图除去氯气中的杂质,洗气装置内的洗涤液一般用
溶液。
实验二:用右图除去氯气中的杂质,洗气装置内的洗涤液一般用
溶液。
某同学用右图装置为了获得较大浓度的氯水,他将进气导管末端连一多孔的球泡,在装置右边气体出口导管处连一干瘪的橡皮气囊,请说明理由:
。
实验三:将制得的氯水转移到锥形瓶中,再加入大理石,并充分振荡,观察到氯水的黄绿色褪去,同时产生少量气体。分别取锥形瓶中上层清液4份,进行如下实验,请用化学式填空:
(1)该清液滴在有色布条上有极强的漂白作用。说明该清液中含有 (写化学式);
(2)该清液中滴加碳酸钠溶液产生白色沉淀。说明该清液中含有 离子;
(3)该清液中滴加盐酸可产生大量气体。该气体是 ;
(4)该清液加热后变浑浊并产生大量气体。加热后产生浑浊的原因是因为生成了 。
(5)通过上述实验,请写出氯水和碳酸钙反应的化学方程式为:
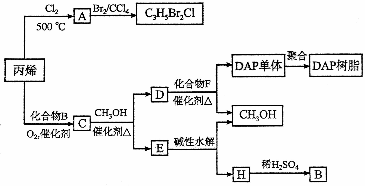
。20.(12分)丙烯可用于合成杀除根瘤线虫的农药(分子式为 )和应用广泛的DAP树脂:
)和应用广泛的DAP树脂:

已知酯与醇可发生如下酯交换反应:
(R、 、
、 代表烃基)
代表烃基)
(1)农药 分子中每个碳原子上均连卤原子。
分子中每个碳原子上均连卤原子。
A含有的官能团名称是 ;由丙烯生成A的反应类型是 。
(2)A水解可得到D,该水解反应的化学方程式是 。
D有多种同分异构体,其氧化产物(分子式为C3H6O2)也有多种同分异构体,现有其中的四种X、Y、Z、W,它们分子中均含甲基,把它们分别进行下列实验以鉴别之,其实验记录如下:
|
|
NaOH溶液 |
银氨溶液 |
新制Cu(OH)2 |
金属钠 |
|
X |
中和反应 |
无现象 |
溶 解 |
产生氢气 |
|
Y |
无现象 |
有银镜 |
加热后有红色沉淀 |
产生氢气 |
|
Z |
水解反应 |
有银镜 |
加热后有红色沉淀 |
无现象 |
|
W |
水解反应 |
无现象 |
无现象 |
无现象 |
则X、Z的结构简式分别为: X ,Z 。
(3)C蒸气密度是相同状态下甲烷密度的6.25倍,C中各元素的质量分数分别为:碳60%,氢8%,氧32%。C的结构简式是 。
(4)下列说法正确的是(选填序号字母) 。
a.C能发生聚合反应、还原反应和氧化反应
b.C含有2个甲基的羧酸类同分异构体有4个
c.D催化加氢的产物与B具有相同的相对分子质量
d.E具有芳香气味,易溶于乙醇
(5)F的分子式为 。DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种。D和F反应生成DAP单体的化学方程式是
。
。DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种。D和F反应生成DAP单体的化学方程式是
。
18.(10分)化学变化中有一种同种元素之间发生电子转移的氧化还原反应,这种反应有时会因溶液酸碱性的变化而改变反应方向,如图所示,已知
甲、乙、丙三种物质中含有同一种元素。
 请回答以下问题:
请回答以下问题:
(1)若乙为Cl2,丙为KClO,则:
①甲的化学式为 。
②反应②的化学方程式为 .
③若将反应①设计成原电池,正极反应过程为 (用“Ⅰ”或“Ⅱ”填空)。
④如右图所示,a、b两电极材料分别为铁钉和石墨。则以下说法不正确的是 (填代号)
A.a 电极不可能作阳极
B.a 电极可能发生反应:2H+
+ 2e-=H2↑

C.b 电极不可能有气体放出
D.a电极可能发生反应:Fe-2e- =Fe2+
(2)若甲、乙、丙中所含相同元素X的化合价分别为a、b、c,且a<b<c,反应①进行过程中其他元素化合价不变,则该反应中氧化产物与还原产物中X元素的物质的量之比为 。(用含a、b、c的代数式表示)。
17.(共12分) A、B、D、E、G为短周期元素,其原子序数依次增大。A元素在周期表中原子半径最小,B元素的最高正化合价和最低负化合价的绝对值相等,E元素的原子最外层电子数是次外层的3倍。E和G可形成离子化合物GE。
试回答下列问题:
(1) 在点燃的条件下,G的单质与化合物BE2反应的方程式 。
(2) 用电子式表示GE的形成过程 。
(3)写出在加热条件下B的单质与D的最高价氧化物的水化物的浓溶液反应的化学方程式 。
(4)写出由上述元素中的四种元素形成的能溶于水的强电解质的化学式 (任写一种)。
(5)将由A分别与B、D、E组成的化合物按沸点由高到低的顺序写出它们的分子式 。
(6)如右图,烧瓶中装有由上述元素形成的化合物。挤压胶头滴管,观察到气球均明显胀大(假定反应完全),则甲烧瓶中盛装的固体化合物的化学式可能为(任写一 种)
,
种)
,
乙烧瓶中盛装的气体化合物的化学式可能为(任写一种) 。
16.常温下,对下列四种溶液的叙述正确的是
|
|
① |
② |
③ |
④ |
|
pH |
10 |
10 |
4 |
4 |
|
溶液 |
氨水 |
氢氧化钠溶液 |
醋酸溶液 |
盐酸 |
A.②、④两溶液相比,两者的kw不相同
B.四种溶液分别加水稀释10倍,pH变化最大的是①和④
C.①、②、③中分别加入少量的醋酸铵固体后,三种溶液的pH均减小
D.①、④ 两溶液按一定体积比混合,所得溶液中离子浓度的关系一定为:
c(NH4+)+ c(H+)=c(Cl-)+ c(OH-)
第Ⅱ卷(非选择题,共52分)
15.含有mol  的溶液中,通入mol
的溶液中,通入mol 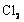 。下列各项为通
。下列各项为通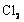 过程中,溶液内发生反应的离子方程式,其中不正确的是( )
过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A. ═
═
B. ═
═
C. ═
═
D. ═
═
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com