
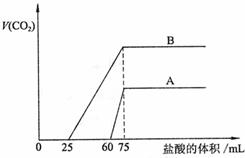
 22.(10分)取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
22.(10分)取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图所示,试回答下列问题:
(1)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)
,各种溶质的物质的量之比为 ;加盐酸后产生CO2体积的最大值为 mL。
(2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)
;加盐酸后产生CO2体积最大值 mL。
(3)通过计算求出原NaOH溶液的物质的量浓度。
21.(8分)在实验室里可用右图所示装置制取次氯酸钠和探究氯水的性质。
 图中:
图中:
① 为氯气发生装置;
装置②的试管里盛有15 mL 8%的
NaOH溶液,并置于冰水浴中;
装置③的试管里加有紫色石蕊试液;
装置④为尾气吸收装置。
请填写下列空白:
⑴ 实验时为了除去氯气中的氯化氢气体,
可在①与②之间安装盛有____________
的净化装置。
⑵ 本实验中制取次氯酸钠的离子方程式是___________________________________。
⑶ 实验中可观察到③的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为_____色 |
氯气与水反应生成的H+使石蕊变色 |
|
随后溶液逐渐变为无色 |
______________________________________ |
⑷ 为了使新制氯水中HClO的浓度增加,可向其中加入适量________________。
A.NaOH B.CaO C.CaCO3(s) D.H2O
20.(13分)在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出)。
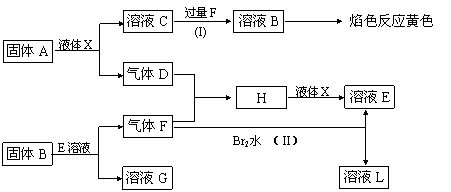
请回答:
(1)写出化学式A ,B ,G 。
(2)C的电子式_______________
(3)X的结构式_______________
(4)写出反应(I)的化学方程式 。
(5)写出反应(II)的离子方程式 。
(6)写出A与X的反应的化学方程式并标出电子转移方向和数目_____________。
19.(10分)
(1)对下列仪器回答下列问题:
A、容量瓶 B、蒸馏烧瓶 C、滴定管 D、量筒 E、烧杯 
F、蒸发皿 G、分液漏斗
①标有“0”刻度的有 (填序号);
②使用时必须检查是否漏水的有 (填序号);
③对允许加热的仪器,加热时必须垫上石棉网的有 (填序号);
(2)现用物质的量的浓度为a mol / L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
①酸式滴定管用蒸馏水洗净后,还应该进行的操作是 ; ②下图是酸式滴定管中液面在滴定前后的读数:
②下图是酸式滴定管中液面在滴定前后的读数:




c(NaOH)= ;
③若在滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏 。
18.(5分)今有5瓶失去标签的溶液,只知道它们分别是:HCl、Na2CO3、NaHCO3、NaOH和Ca(HCO3)2的水溶液,为了鉴别它们,分别以A、B、C、D、E为代号,用它们进行一些实验,记录如下:A与B混合时无明显现象;B与C混合时有沉淀生成;B与D混合后生成了E;A能使石蕊试液变红。由此推知:
A是
B是
C是
D是
E是
。
17.(4分)已知X和Y均是短周期元素中的同主族元素的单质,W、V是化合物,它们有如下变化关系:X+W→Y+V
试写出符合题意,且满足下列关系的化学方程式:
(1)W是水
;
(2)V是水
。
16.某研究性学习小组在老师指导下做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色。判断下列说法中正确的是 ( )
 A.该条件下生成的水分子化学性质比较活泼
A.该条件下生成的水分子化学性质比较活泼
B.该条件下H2被冷却为液态氢,液氢的水溶液具有
还原性
C.该条件下H2燃烧生成了具有还原性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
第Ⅱ卷(非选择题,共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com