
31.(8分)A、X、Y、Z是中学常见的单质和化合物。它们在一定条件下能发生如下转化,转化中的部分产物已省略。

(1)若A为氧化性的单质,Z为淡黄色固体。则Z中阴阳离子个数的最简比是 ;如果将Z投入到含有少量酚酞的水溶液中可能出现象是 。
(2)若X为黑色非金属单质,A既是氧化物又是氢化物。写出X在一定条件下转化为Y的化学反应方程式: 。
(3)若X是由主族元素和过渡元素形成的化合物(俗名:黄铁矿),且上述转化是无机化工中生产某种酸的重要反应。则:
X Y的化学反应方程式为 ;
30.(6分)A、B、C、D、X均为中学化学常见的物质。它们之间存在如下图所示转化关 系(图中反应条件略去)
系(图中反应条件略去)
填写下列空白。
(1)若A为金属铝,B为氧化铁,写出反应A + B → C + D的一种用途 。
(2)若A、B、C、D都是化合物,其中A为H2O, B、C、D均含有氮元素,则B为 色气体。
(3)若A为金属单质,B、C、D都是化合物,A与B发生的反应常用于制作印刷电路板,该反应的离子方程式为 。
(4)若A、B、C为化合物,D、X为单质,A、B、C中肯定含有X元素的是 。
29.(12分)有一可能含Cu2+、Al3+、Mg2+、Na2+、Cl-、CO32-、SO42-的溶液。加入BaCl2产生白色沉淀;加入稀HCl溶液,没有气体产生;若加入Na2O2则有无色无味气体产生,并生成白色沉淀,加入Na2O2的量与生成白色沉淀量关系如图所示,则:
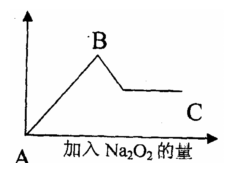 (1)上述溶液中一定无
离子,
(1)上述溶液中一定无
离子,
可能有 离子,曲线BC说
明 离子肯定存在。
(2)加入Na2O2产生无色无味气体的化学
方程式为 ;
加入BaCl2产生白色沉淀的离子方程
式为 ;
曲线B-C段所发生的反应的离子方
程式为 。
28.(9分)某同学用如图所示的装置来探究SO2的性质及有关实验。
(1)实验室用亚硫酸钠固体与硫酸反应制取SO2气体,写出该反应的化学方程式 。
(2)将制取的SO2气体通入C溶液中,请回答下列问题:
①若C溶液是紫色石蕊试液,通入少量SO2气体后,现象是 ,继续通入过量的SO2气体,现象是 。
②若C溶液是橙色的溴水溶液,通入SO2气体后现象是 ,写出反应的离子方程式 。
③若C溶液是澄清石灰水,缓慢且持续通入SO2气体过程中,观察到的现象是 。
25.铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
A.9.02g B.8.51g C.8.26g D.7.04g


24.工业废气中氮的氧化物是重要的污染源,有一种治理污染的方法是通入适量氨气将其还原为无毒物质N2和H20,现有含氮氧化物NO和NO2的混合气体3L,用同条件下的NH33.50L恰好反应完全,则混合气体中NO和NO2的体积分数比为
A.1:4 B.1:3 C.1:2 D.1:l
23.向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol/L的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.24mol B.0.21mol C.0.16mol D.0.14mol
22.已知2Fe2++Br2══2Fe3++2Br-,若向100 mL 的FeBr2溶液中通入标准状况下的Cl2 3.36L,测得形成的溶液中Cl-和Br-的物质的量浓度相等,则FeBr2溶液的物质的量浓度为
A.0.75 mol.L-1 B.1.5mol.L-1 C.2 mol.L-1 D.0.3mol.L-1
21.某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验。

实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟。以下叙述错误的是
A.钠着火燃烧产生苍白色火焰 B.反应生成的大量白烟是氯化钠晶体
C.管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
D.管右端棉球外颜色变化可判断氯气是否被碱液完全吸收
20.将一定体积稀硝酸溶液平均分成两份,一份与足量的铜粉反应收集到气体的体积为Vl;另一份先加入与其等体积的稀硫酸,再投入足量的铜粉收集到气体的体积为V2(Vl和V2都在同一条件下 测定),已知V2=3Vl,则稀硝酸和稀硫酸的物质的量浓度之比为
A、1:1 B、l:2 C、1:3 D、无法确定 .
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com