

10.(重庆理综第10题,6分)物质的量浓度相同的下列溶液,pH由大到下排列正确的是
A.Ba(OH)2 、Na2SO3 、FeCl3 、KCl B.Na2SiO3 、Na2CO3 、KNO3 、NH4Cl
C.NH3 ·H2O 、H3PO4 、Na2SO4 、H2SO4 D.NaHCO3 、C6H5COOH 、C2H5OH 、HCl
9.答案:D
解析:根据电荷守恒,离子浓度最大的和最小的带同种电性,A错误;Na2CO3溶液加水稀释后,虽然稀释促进了碳酸钠的水解,氢氧根离子的绝对数量有所增加,但是由于稀释的对溶液浓度的影响远大于平衡移动的影响,碳酸钠溶液中的氢氧根浓度减小符合题意,但是Kw是温度的函数,温度不变,Kw不变,B错误;pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,溶液中的c(H+)相等,水电离出来的c(H+)不等,pH=5的CH3COOH溶液中水电离出来的氢离子浓度等于水电离出来的氢氧根浓度,溶质电离出来的氢离子浓度c(H+)=10-5mol/L,KW=1×0-14
,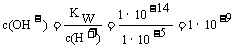 ,
,
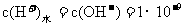 ,pH=5的NH4Cl溶液中,由于铵根离子结合水电离出来的氢氧根离子,促进了水的电离,水电离出来的氢离子浓度就是NH4Cl溶液中的氢离子浓度,c(H+)=1×10-5
,C 错误;在Na2S溶液中加入AgCl固体,发生沉淀的转移生成更难溶的硫化银沉淀:2AgCl+Na2S=Ag2S↓+2NaCl
, 致使溶液中c(S2-)下降,D正确。
,pH=5的NH4Cl溶液中,由于铵根离子结合水电离出来的氢氧根离子,促进了水的电离,水电离出来的氢离子浓度就是NH4Cl溶液中的氢离子浓度,c(H+)=1×10-5
,C 错误;在Na2S溶液中加入AgCl固体,发生沉淀的转移生成更难溶的硫化银沉淀:2AgCl+Na2S=Ag2S↓+2NaCl
, 致使溶液中c(S2-)下降,D正确。
要点:沉淀的转移:在Na2S溶液中加入AgCl(AgBr 、AgI)固体,溶液中c(S2-)都下降,因为Ag2S的溶解度比AgCl(AgBr 、AgI)的溶解度更小。
9.(天津理综第4题,6分)下列叙述正确的是
A.0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降
8。 答案:B
答案:B
解析:四种溶液有共同的成分CH3COONa,比较溶液的酸碱性就比较另一种成分即可,0.1mol/L的四种溶液HCl(强酸)、NaOH(强碱)、NaCl(中性盐)、NaHCO3 (强碱弱酸盐)的pH关系:②>④>③>①,A错误;c(H+)关系:①>③>④>②,C错误;CH3COONa水解呈碱性,另一种溶液碱性越强,越抑制醋酸根水解,c(CH3COO-)浓度越大,所以c(CH3COO-)浓度关系和pH关系相同:②>④>③>①,B对;CH3COONa水解呈碱性,另一种溶液酸性越强,越促进醋酸根水解,c(CH3COOH)浓度越大,所以c(CH3COOH)浓度关系和c(H+)关系相同: ①>③>④>②,D错误。
要点1:等浓度溶液pH的大小顺序为:二元强碱、一元强碱、一元弱碱(强碱弱酸盐)、强酸强碱盐、(强酸弱碱盐)一元弱酸、一元强酸、二元强酸。
要点2:CH3COONa水解呈碱性,加热促进水解,c(CH3COO-)减小,c(CH3COOH)增大;通入氯化氢气体,促进水解,c(CH3COO-)减小,c(CH3COOH)增大;加入碱性或水解呈碱性的固体,抑制水解,c(CH3COO-)增大,c(CH3COOH)减小。
8.(北京理综第11题,6分)有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成:①CH3COONa和HCl;②CH3COONa和NaOH;③CH3COONa和NaCl;④CH3COONa和NaHCO3
;列各项排序正确的是
A.pH:②>③>④>①
B.c(CH3COO-):②>④>③>①
C.溶液中c(H+):①>③>②>④ D.c(CH3COOH):①>④>③>② 学
学
7.答案:C
解析:根据以下反应得出酸性由强到弱的顺序:
CH3COOH>H2CO3 :2CH3COOH+CaCO3=(CH3COO)2Ca+H2O+CO2 ↑
H2CO3>C6H5OH :C6H5ONa+H2O+CO2 →C6H5OH+NaHCO3
根据以下反应得出碱性强弱顺序:Na2CO3>C6H5ONa :C6H5OH+Na2CO3 →C6H5ONa+NaHCO3
C6H5ONa> NaHCO3 :C6H5ONa+H2O+CO2 →C6H5OH+NaHCO3
溶液酸性越强,pH越小;溶液水解碱性越强,pH越大,按溶液pH由小到大排列正确的是①④②⑥③⑤。
7.(全国II卷理综第10题,6分)现有等浓度的下列溶液:①醋酸、②苯酚、③苯酚钠、④碳酸、⑤碳酸钠、⑥碳酸氢钠。按溶液pH由小到大排列正确的是
A.④①②⑤⑥③ B.④①②⑥⑤③ C.①④②⑥③⑤ D.①④②③⑥⑤
6.答案:C
解析:滴定过程中始终存在电荷守恒:c(Cl-)+c(OH-)=c(H+)+
c(NH ),也存在:c(Cl-)- c(NH
),也存在:c(Cl-)- c(NH )= c(H+)- c(OH-)
)= c(H+)- c(OH-)
当c(Cl-)- c(NH )= c(H+)- c(OH-)>0溶液呈酸性时,c(Cl-)>c(NH
)= c(H+)- c(OH-)>0溶液呈酸性时,c(Cl-)>c(NH ), c(H+)>c(OH-)出现D选项的情形。
), c(H+)>c(OH-)出现D选项的情形。
当c(Cl-)- c(NH )= c(H+)- c(OH-)=0溶液呈中性时,c(Cl-)=c(NH
)= c(H+)- c(OH-)=0溶液呈中性时,c(Cl-)=c(NH ), c(H+)=c(OH-)出现B选项的情形。
), c(H+)=c(OH-)出现B选项的情形。
当c(Cl-)- c(NH )= c(H+)- c(OH-)<0溶液呈碱性时,c(Cl-)<c(NH
)= c(H+)- c(OH-)<0溶液呈碱性时,c(Cl-)<c(NH ), c(H+)<c(OH-)出现A选项的情形。
), c(H+)<c(OH-)出现A选项的情形。
无论何时都不会出现C选项的情形。
要点:滴定过程中先后出现的几种可能的离子浓度关系:
①.溶液呈酸性时,溶质有三种可能:盐酸和氯化铵、氯化铵、氯化铵和氨水;离子浓度有三种情形:c(Cl-)>c(H+)>c(NH )>c(OH-)、c(Cl-)>
c(H+) = c(NH
)>c(OH-)、c(Cl-)>
c(H+) = c(NH ) >c(OH-)、c(Cl-)>c(NH
) >c(OH-)、c(Cl-)>c(NH )>c(H+)>c(OH-) 。
)>c(H+)>c(OH-) 。
②.溶液呈中性时,溶质只有一种可能:氯化铵和氨水;离子浓度有一种情形:c(Cl-)
= c(NH ) >c(H+) =c(OH-) 。
) >c(H+) =c(OH-) 。
③.溶液呈碱性时,溶质只有一种可能:氯化铵和氨水;离子浓度有三种情形。c(NH ) >c(Cl-) > c(OH-) > c(H+), c(NH
) >c(Cl-) > c(OH-) > c(H+), c(NH ) >c(Cl-) = c(OH-)> c(H+)
;c(NH
) >c(Cl-) = c(OH-)> c(H+)
;c(NH ) >c(OH-)> c(Cl-) > c(H+)。
) >c(OH-)> c(Cl-) > c(H+)。
6.(全国I理综第10题,6分)用0.10
mol·L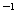 的盐酸滴定0.10 mol·L
的盐酸滴定0.10 mol·L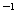 的氨水,滴定过程中不可能出现的结果是
的氨水,滴定过程中不可能出现的结果是
A.c(NH ) >c(Cl-) ,c(OH-)
> c(H+) B. c(NH
) >c(Cl-) ,c(OH-)
> c(H+) B. c(NH ) = c(Cl-) ,c(OH-)
= c(H+)。
) = c(Cl-) ,c(OH-)
= c(H+)。
C.c(Cl-)>c(NH ) ,c(OH-) > c(H+) D. c(Cl-)>c(NH
) ,c(OH-) > c(H+) D. c(Cl-)>c(NH ) ,c(H+)>c(OH-)
) ,c(H+)>c(OH-)
5. 答案B
答案B
 详解:A项氯化铵为强电解质完全电离后产生大量的NH4+;氨水为弱电解质只有少量的NH4+产生。B项在水中加入酸和碱都抑制水的电离,盐酸是强酸抑制水的电离的程度大,B项不正确。①和②等体积混合后的溶液恰好是氯化铵溶液,溶剂守恒式:c(H+)=c(OH
详解:A项氯化铵为强电解质完全电离后产生大量的NH4+;氨水为弱电解质只有少量的NH4+产生。B项在水中加入酸和碱都抑制水的电离,盐酸是强酸抑制水的电离的程度大,B项不正确。①和②等体积混合后的溶液恰好是氯化铵溶液,溶剂守恒式:c(H+)=c(OH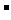 )+c(NH3·H2O),C正确;①和③等体积混合后的溶液形成的是pH>7的缓冲溶液,以氨水的电离为主,D选项正确。
)+c(NH3·H2O),C正确;①和③等体积混合后的溶液形成的是pH>7的缓冲溶液,以氨水的电离为主,D选项正确。
 要点1:浓度相同的氨水和氯化铵溶液,氯化铵溶液中的c(NH+4)大;浓度相同的醋酸溶液和醋酸钠溶液,醋酸钠溶液中的c(CH3COO-)大。
要点1:浓度相同的氨水和氯化铵溶液,氯化铵溶液中的c(NH+4)大;浓度相同的醋酸溶液和醋酸钠溶液,醋酸钠溶液中的c(CH3COO-)大。
要点2:相同温度下,同浓度同元数的强酸溶液比弱酸溶液更能抑制水的电离,强酸溶液中水电离出来的氢离子浓度更小。
要点3:氯化铵溶液中的三守恒一大小关系:
(1)溶质守恒:c(Cl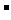 )=
c(NH
)=
c(NH )+ c(NH3·H2O)
)+ c(NH3·H2O)
(2)溶剂守恒:c(H+)=c(OH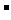 )+c(NH3·H2O)
)+c(NH3·H2O)
(3)电荷守恒:c(NH ) +c(H+)=c(Cl
) +c(H+)=c(Cl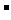 )+c(OH
)+c(OH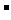 )
)
(4)大小关系:c(Cl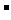 )>c(NH
)>c(NH )>c(H+)>c(OH
)>c(H+)>c(OH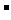 )
)
-----------------------------------------------------------------------------------------------------------------------------------------
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com