

5.如果直线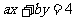 与圆
与圆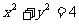 有两个不同的交点,那么
有两个不同的交点,那么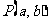 与圆的位置关系是( )
与圆的位置关系是( )
(A) 在圆外 (B) 在圆上
(C) 在圆内 (D) 不确定
4.已知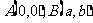 两点,其中
两点,其中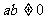 ,
,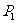 是
是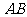 的中点,
的中点,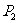 是
是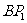 的中点,
的中点,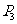 是
是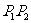 的中点,…
的中点,…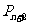 是
是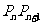 的中点,则点
的中点,则点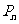 的极限位置是( )
的极限位置是( )
(A) 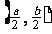 (B)
(B)
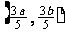
(C) 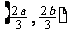 (D)
(D)
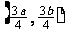
3.直线沿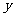 轴正方向平移
轴正方向平移
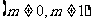 个单位,再沿
个单位,再沿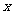 轴负方向平移
轴负方向平移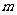 -1个单位得直线
-1个单位得直线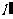 ,若直线
,若直线 与
与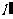 重合,则直线
重合,则直线 的斜率为( )
的斜率为( )
(A) 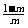 (B)
(B)
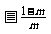
(C) 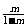 (D)
(D)
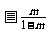
2.已知直线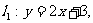 直线
直线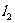 与
与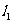 关于直线
关于直线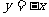 对称,直线
对称,直线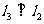 ,则
,则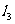 的斜率为( )
的斜率为( )
(A) 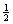 (B)
-
(B)
-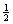
(C) -2 (D) 2
1.直线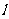 经过点A(2,1)、B(1,
经过点A(2,1)、B(1,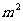 ) (
) (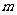
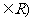 两点,那么直线
两点,那么直线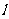 的倾斜角的范围是( )
的倾斜角的范围是( )
(A) 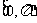 (B)
(B)
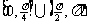
(C) 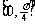 (D)
(D)
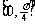
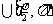
17.答案:BC
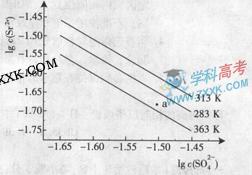
详解:Ksp只与温度有关,与浓度大小无关,A错误;根据图中显示:三个不同温度中,313K时沉淀溶解平衡曲线中的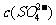 、c(Sr2+)最大,Ksp(SrSO4)最大,B正确;图中a点在283K沉淀溶解平衡曲线的下方,Qc<Ksp,对应的溶液是不饱和溶液,C正确; 283K下的SrSO4饱和溶液升温到363K后,Qc>Ksp,饱和溶液变为过饱和溶液,D错误。
、c(Sr2+)最大,Ksp(SrSO4)最大,B正确;图中a点在283K沉淀溶解平衡曲线的下方,Qc<Ksp,对应的溶液是不饱和溶液,C正确; 283K下的SrSO4饱和溶液升温到363K后,Qc>Ksp,饱和溶液变为过饱和溶液,D错误。
 要点1:对于沉淀溶解平衡:MmAn(s)
mMn+ (aq)+nAm-(aq),平衡常数为:Ksp=[c(Mn+)]m
·[c(Am-)]n
要点1:对于沉淀溶解平衡:MmAn(s)
mMn+ (aq)+nAm-(aq),平衡常数为:Ksp=[c(Mn+)]m
·[c(Am-)]n
说明:固体纯物质不列入平衡常数。
要点2:在一定温度下,Ksp(溶度积)是一个常数,是一个只与温度有关的常数,只有温度的改变Ksp才会发生变化,与浓度的变化与否无关。
要点3:比较溶度积与离子积的相对大小,判断难溶电解质在给定条件下沉淀能否生成或溶解:
(1)Qc>Ksp ,溶液过饱和,有沉淀析出,直至溶液饱和,达到新的平衡。
(2)Qc=Ksp ,沉淀于溶解处于平衡状态。
(3)Qc<Ksp,溶液未饱和,无沉淀析出,若加入过量难溶电解质,难溶电解质溶解直至溶液饱和。
17.(广东化学卷第18题,4分)硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下,下列说法正确的是
A.温度一定时,Ksp(SrSO4)随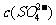 的增大而减小
的增大而减小
B.三个不同温度中,313K时Ksp(SrSO4)最大
C.283K时,图中a点对应的溶液是不饱和溶液
D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液

16.答案:D
详解:1体积水溶解2体积氯气,溶于水的部分氯气和水反应生成盐酸和次氯酸,即氯气和水的反应是可逆反应,与水反应的氯气不一定是溶于水的氯气的一半,A错误;氯水中:Cl2+H2O HCl+HClO;HCl=H+
+Cl- ;HClO
HCl+HClO;HCl=H+
+Cl- ;HClO H+
+ClO- ;氯气和水反应生成的等量的盐酸和次氯酸,盐酸全部电离,次氯酸部分电离,酸性溶液中c(OH-)最小,c(H+)>c(Cl-)>c(ClO-)>c(OH-)
H+
+ClO- ;氯气和水反应生成的等量的盐酸和次氯酸,盐酸全部电离,次氯酸部分电离,酸性溶液中c(OH-)最小,c(H+)>c(Cl-)>c(ClO-)>c(OH-) ,B错误;等体积等浓度的氢氧化钠与醋酸混合恰好生成醋酸钠和水,分析溶液中的离子浓度关系实质上是分析产物醋酸钠溶液中的离子浓度关系,根据电荷守恒式c(Na+)+ c(H+)= c(CH3COO-)+
,B错误;等体积等浓度的氢氧化钠与醋酸混合恰好生成醋酸钠和水,分析溶液中的离子浓度关系实质上是分析产物醋酸钠溶液中的离子浓度关系,根据电荷守恒式c(Na+)+ c(H+)= c(CH3COO-)+ c(OH-)得出变换的电荷守恒式为:c(Na+)- c(CH3COO-) =
c(OH-)得出变换的电荷守恒式为:c(Na+)- c(CH3COO-) = c(OH-)
-c(H+),因为醋酸钠水解呈碱性,c(OH-)>c(H+),所以c(Na+)>c(CH3COO-),C错误;
c(OH-)
-c(H+),因为醋酸钠水解呈碱性,c(OH-)>c(H+),所以c(Na+)>c(CH3COO-),C错误; Na2CO3溶液中有两个电离方程式和两个水解的离子方程式(Na2CO3=2Na+ + CO
Na2CO3溶液中有两个电离方程式和两个水解的离子方程式(Na2CO3=2Na+ + CO ;H2O
;H2O H+
+OH- ;CO
H+
+OH- ;CO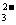 +H2O
+H2O HCO
HCO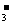 +OH- , HCO
+OH- , HCO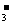 +H2O
+H2O  H2CO3+OH-
);①不考虑水解:溶液中只有四种离子(Na+ 、CO
H2CO3+OH-
);①不考虑水解:溶液中只有四种离子(Na+ 、CO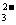 、H+ 、OH-)溶液呈中性;离子浓度关系有:c(Na+)=2c(CO
、H+ 、OH-)溶液呈中性;离子浓度关系有:c(Na+)=2c(CO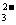 );c(H+)=c(OH-),②考虑水解:由于CO
);c(H+)=c(OH-),②考虑水解:由于CO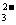 水解,溶液中的微粒成分增加了两种成份(HCO
水解,溶液中的微粒成分增加了两种成份(HCO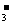 、H2CO3),并破坏了原先的离子浓度的等式关系,CO
、H2CO3),并破坏了原先的离子浓度的等式关系,CO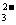 在破坏水的电离平衡的同时,自身浓度也发生了变化,导致c(Na+)> 2c(CO
在破坏水的电离平衡的同时,自身浓度也发生了变化,导致c(Na+)> 2c(CO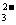 )和c(H+)<c(OH-);在CO
)和c(H+)<c(OH-);在CO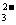 的第一步水解的离子方程式(CO
的第一步水解的离子方程式(CO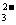 +H2O
+H2O HCO
HCO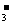 +OH-)中可以看出产物c(OH-)= c(HCO
+OH-)中可以看出产物c(OH-)= c(HCO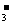 ),由于CO
),由于CO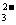 第二步水解(HCO
第二步水解(HCO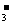 +H2O
+H2O  H2CO3+OH-
)的发生,导致c(HCO
H2CO3+OH-
)的发生,导致c(HCO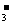 )减少的同时又增加了c(OH-),使得c(OH-)>c(HCO
)减少的同时又增加了c(OH-),使得c(OH-)>c(HCO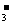 ),在盐溶液中,单一的水解是微弱的,溶质电离出来的离子的浓度一定大于水解反应新增的离子浓度,水解呈碱性的溶液中氢离子浓度最小,得出离子浓度关系式D正确。
),在盐溶液中,单一的水解是微弱的,溶质电离出来的离子的浓度一定大于水解反应新增的离子浓度,水解呈碱性的溶液中氢离子浓度最小,得出离子浓度关系式D正确。
要点1:溶液混合后离子浓度的分析试题解题方法:首先要写出产物的电离方程式、水解方程式,其次分析出溶液中的微粒(离子、分子)成分,并写出电荷守恒式、溶质守恒式、溶剂守恒式,最后根据题给信息(溶液的酸碱性信息)和以上三式(电荷守恒式、溶质守恒式、溶剂守恒式)导出离子浓度的大小关系。
要点2:等体积等浓度的氢氧化钠与醋酸混合后溶液中的离子浓度关系有:
(1)溶质守恒: c(Na+)=c(CH3COO-)+c(CH3COOH)
 ;c(Na+)>c(CH3COO-)
;c(Na+)>c(CH3COO-)
(2)溶剂守恒:c(H+)+
c(CH3COOH) =c(OH-);c(H+)>c(OH-)
=c(OH-);c(H+)>c(OH-)
(3)电荷守恒:c(Na+)+
c(H+)= c(CH3COO-)+ c(OH-)
c(OH-)
(4)大小关系:溶质离子的浓度大于溶剂离子的浓度(单一水解是微弱的)
c(Na+)>c(CH3COO-)> c(H+)>c(OH-)。
要点3:Na2CO3溶液中的离子浓度关系有:
(1)溶质守恒: c(Na+)=2[c(CO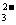 )+c(HCO
)+c(HCO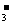 ) + c(H2CO3)]
) + c(H2CO3)] ;c(Na+)>
2c(CO
;c(Na+)>
2c(CO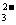 )
)
(2)溶剂守恒:c(H+)+
c(HCO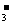 )+2 c(H2CO3)
)+2 c(H2CO3) =c(OH-);c(H+)<c(OH-)
=c(OH-);c(H+)<c(OH-)
(3)电荷守恒:c(Na+)+
c(H+)= 2c(CO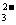 )+c(HCO
)+c(HCO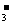 ) +
) + c(OH-)
c(OH-)
(4)大小关系:溶质离子的浓度大于溶剂离子的浓度(单一水解是微弱的)
c(Na+)>c(CO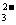 )
) >c(OH-)> c(HCO
>c(OH-)> c(HCO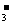 )>c(H+)
)>c(H+)
16. (广东化学卷第9题,3分)下列浓度关系正确的是
(广东化学卷第9题,3分)下列浓度关系正确的是
A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+C(HClO)]
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)

D.Na2CO3溶液中:c(Na+)>c(CO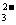 )
) >c(OH-)> c(HCO
>c(OH-)> c(HCO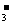 )>c(H+)
)>c(H+)
15. 答案:AC
答案:AC
 详解:NH4HSO4溶液中滴加NaOH溶液有两个主要反应:2NH4HSO4+2NaOH=Na2SO4+(NH4)2SO4+2H2O(I)和NH4HSO4+2NaOH=Na2SO4+NH3
·H2O+H2O(II),在II式中溶液呈碱性,不符合题意;在I式中由于NH
详解:NH4HSO4溶液中滴加NaOH溶液有两个主要反应:2NH4HSO4+2NaOH=Na2SO4+(NH4)2SO4+2H2O(I)和NH4HSO4+2NaOH=Na2SO4+NH3
·H2O+H2O(II),在II式中溶液呈碱性,不符合题意;在I式中由于NH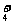 水解呈酸性,有离子浓度关系式:c(Na+)=c(SO
水解呈酸性,有离子浓度关系式:c(Na+)=c(SO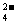 )>c(NH
)>c(NH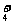 ),题给信息溶液呈中性,必须向溶液中继续滴入NaOH溶液才能使溶液呈中性,继续滴入NaOH导致n(Na+)增大的同时n(NH
),题给信息溶液呈中性,必须向溶液中继续滴入NaOH溶液才能使溶液呈中性,继续滴入NaOH导致n(Na+)增大的同时n(NH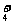 )减小,n(SO
)减小,n(SO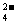 )不变,溶液中的溶质离子浓度关系:c(Na+)>c(SO
)不变,溶液中的溶质离子浓度关系:c(Na+)>c(SO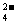 )>c(NH
)>c(NH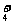 ),A正确。NaHCO3溶液中因为HCO
),A正确。NaHCO3溶液中因为HCO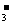 结合水电离出来的H+破坏水的电离平衡使得溶液呈碱性[c(OH-)>c(H+)]的同时c(Na+)>
c(HCO
结合水电离出来的H+破坏水的电离平衡使得溶液呈碱性[c(OH-)>c(H+)]的同时c(Na+)>
c(HCO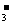 ),由于单一水解是微弱的,溶质离子的浓度大于溶剂离子的浓度,得出c(Na+)> c(HCO
),由于单一水解是微弱的,溶质离子的浓度大于溶剂离子的浓度,得出c(Na+)> c(HCO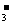 )>c(OH-)>c(H+),B错误;Na2CO3溶液不水解时有溶剂守恒:c(H+) =c(OH-),由于CO
)>c(OH-)>c(H+),B错误;Na2CO3溶液不水解时有溶剂守恒:c(H+) =c(OH-),由于CO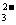 水解生成HCO
水解生成HCO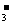 、H2CO3的时候分别消耗了1份、2份H+,考虑CO
、H2CO3的时候分别消耗了1份、2份H+,考虑CO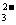 水解的溶剂守恒式为:c(OH-)=c(H+)+c(HCO
水解的溶剂守恒式为:c(OH-)=c(H+)+c(HCO )+2 c(H2CO3)
)+2 c(H2CO3) ,C正确。25℃时,浓度均为0.1mol/L 的CH3COOH 、CH3COONa混合溶液,CH3COOH溶液电离呈酸性,CH3COONa溶液水解呈碱性,而溶液混合pH=4.75[c(OH-)<c(H+)],说明溶液混合后CH3COOH电离起决定作用CH3COONa水解可以忽略,c(CH3COOH)减小,c(CH3COO-)增大,得出离子浓度关系:c(CH3COO-)> c(CH3COOH),可以得出关系:c(CH3COO-)- c(CH3COOH)> c(H+)-
c(OH-)>0,即:c(CH3COO-)+ c(OH-)> c(H+)+ c(CH3COOH),D错误。
,C正确。25℃时,浓度均为0.1mol/L 的CH3COOH 、CH3COONa混合溶液,CH3COOH溶液电离呈酸性,CH3COONa溶液水解呈碱性,而溶液混合pH=4.75[c(OH-)<c(H+)],说明溶液混合后CH3COOH电离起决定作用CH3COONa水解可以忽略,c(CH3COOH)减小,c(CH3COO-)增大,得出离子浓度关系:c(CH3COO-)> c(CH3COOH),可以得出关系:c(CH3COO-)- c(CH3COOH)> c(H+)-
c(OH-)>0,即:c(CH3COO-)+ c(OH-)> c(H+)+ c(CH3COOH),D错误。
 要点1:两种溶液反应至中性的混合液中离子浓度分析一定要借助反应的化学方程式进行分析。
要点1:两种溶液反应至中性的混合液中离子浓度分析一定要借助反应的化学方程式进行分析。
要点2:缓冲溶液中的离子浓度分析一定要借助缓冲溶液的酸碱性帮助分析确定电离和水解哪种因素起决定作用。
要点3:单一溶液中的离子浓度分析要考虑三个守恒式(溶质、溶剂、电荷)和一个大小关系式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com