
25.(10分)将一定量的晶体A,隔绝空气加热到200℃时,A全部分解为等物质的量的四种气体。这四种物质与其它物质的相互转化关系如下图所示,J是一种常见的金属单质,C是一种非极性分子。图中部分反应条件及生成物没有列出。
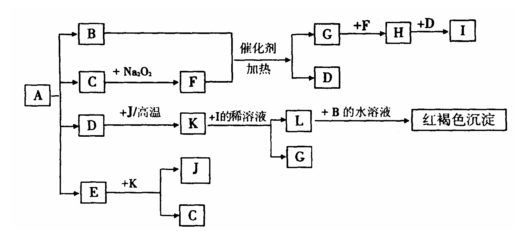
请按要求填空:
(1)单质J的化学式是 ,E的分子式是 。
(2)写出B和F反应的化学方程式 。
(3)写出K和I的稀溶液瓜的离子方程式 。
(4)A的化学式为 。
24.(4分) (1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式: 。
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:
。
23.(8分)氢硼化钠(NaBH4)在医学上有很重要的用途,可用来检验先天性白内障,它具有很强的还原性,被称为“万能还原剂”,它既不能与水共存,又不能与酸共存。
(1)将NaBH4投入水中,可生成偏硼酸钠和氢气,写出该反应的化学方程式,并用单线桥法标出电子转移的方向和数目:___________ _,其中还原剂是_____ _______。
(2)将NaBH4投入强酸溶液中,其反应速率比NaBH4跟水反应_______________(填“快”或“慢”),其理由是_____________________________________。
22.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是 ( )
A.K+一定存在,Cl-可能存在 B.100mL溶液中含0.01mol CO32-
C.K+可能存在,Cl-一定存在 D.Ba2+一定不存在,Mg2+可能存
 第Ⅱ卷 (非选择题 共56分)
第Ⅱ卷 (非选择题 共56分)
21.已知:①向KC1O3晶体中滴加浓盐酸,产生黄绿色气体;②向NaI溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是www. ( )
A.实验③说明KI被氧化
B.实验②中氧化剂还原剂的物质的量之比为2:1
C.实验①证明C1-具有还原性
D.上述实验证明氧化性:C1O3-<C12<I2
20.密度为0.91 g·cm-3的氨水,质量分数为25%,该氨水用等体积的水稀释后,所得溶液的质量分数为 ( )
A.等于12.5% B.大于12.5% C.小于12.5% D.无法确定
19.据某科学杂志报道,国外有一研究发现了一种新的球形分子,它的分子式为C60Si60,其分子结构好似中国传统工艺品“镂雕”,经测定其中包括C60,也有Si60结构。下列叙述不正确的是 ( )
A.该物质有很高的熔点、很大的硬度
B.该物质形成的晶体属分子晶体
C.该物质分子中C60被包裹在Si60里面
D.该物质的相对分子质量为2400
18.在标准状况下,VL氨气溶于水配成1L密度为ρg/cm3的氨水,该氨水的物质的量浓度为 ( )
A.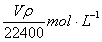 B.
B.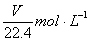
C.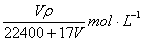 D.
D.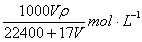
17.在一密闭烧瓶中注入NO2,在25℃时建立下列平衡:2NO2(g) N2O4(g);△H<0,若把烧瓶置于100℃的沸水中,下列情况:①颜色②平均摩尔质量③质量④压强⑤密度中不变的是
( )
N2O4(g);△H<0,若把烧瓶置于100℃的沸水中,下列情况:①颜色②平均摩尔质量③质量④压强⑤密度中不变的是
( )
A. ②④ B.③④ C.③⑤ D.①③
16.用NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.2.24LCO2中含有的原子数为0.3 NA
B.0.1L3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3 NA
C.5.6g铁粉与硝酸反应失去的电子数一定为0.3 NA
D.4.5g SiO2晶体中含有的硅氧键数目为0.3 NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com