
1.将40mL1.5mol.L-1的CuSO4溶液与30mL3mol·L-1的NaOH溶液混合,生成浅篮色沉淀,假如溶液中Cu2+或OH-浓度都已变得很小,可忽略,则生成沉淀的组成可表示为
A.Cu(OH)2 B.CuSO4·Cu(OH)2
C.CuSO4·2Cu(OH)2 D.CuSO4·3Cu(OH)2
2.根据某原子守恒或电子守恒,直接写出关系式。
常用的关系式有S-H2SO4,FeS-2H2SO4,NH3-HNO3等。
题型五 差量法
[例题9] 有NaCl和NaBr的混合物16.14g,溶解于水中配成溶液。向溶液中加入足量的AgNO3溶液,得到33.14g沉淀。则原混合物中钠元素的质量分数为
A.28.5% B.50% C.52.8% D.82.5%
[解析] NaCl+AgNO3===AgCl↓+NaNO3;NaBr+AgNO3===AgBr↓+NaNO3, 即:NaCl→AgCl,NaBr→AgBr,银元素替换了钠元素。因此沉淀比混合物增重部分就是银元素比钠元素增重的部分。设Na元素的质量为xg
Na → Ag △m
23 g 108 g 108 g-3 g==85 g
x 33.14 6-16.14 g==17 g
==,解得:x==4.6,所以Na%==(4.6g/16.14 g)×100%==28.5%。
[借鉴意义] 差量法是根据反应前后物质的量发生变化,找出"理论差量",再根据题意得出"实际差量",两者列成比例关系,然后求解。这个差量可以是质量、物质的量、气体的体积等。比如例题9中用到的质量差,又如2Na2O2+2CO2===2Na2CO3+O2↑反应前后的气体体积差为1,质量差为56。
题型六 十字交叉法、归中原理
[例题10] 由锌、铁、铝、镁四种金属中的两种组成的混和物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2升,则混和物中一定含有的金属是
A.锌 B.铁 C.铝 D.镁
[解析] 本题利用平均摩尔电子质量求解,据10克金属与足量的盐酸反应产生的氢气在标准状况下为11.2升可得金属平均摩尔电子质量为10g/mol。四种金属的摩尔电子质量分别为:Zn:32.5 g/mol、Fe:28 g/mol、Al:9g/mol、Mg:12g/mol,其中只有Al的摩尔电子质量小于10g/mol,故答案为C。
[例题11] 某乙烯和乙炔的混合气体完全燃烧时,所需O2的体积是原混合气体体积的2.7倍,则该混合气体若与足量H2完全加成,消耗H2的体积将是原混合气体体积的
A.1.2倍 B.1.4倍 C.1.6倍 D.1.8倍
[解析] 由燃烧方程式知,1 mol乙烯、乙炔分别耗氧为3 mol和2.5mol,平均耗氧2.7mol,可用十宁交叉法得出二者之比为2:3。再由加成反应可得出:2×l+3×2==8,8/5==1.6。故选C。
[例题12] 将1 molCO(g)和1 molH2O(g)充入某固定容积的反应器中,在一定条件下CO(g)+H2O(g)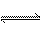 CO2(g)+H2(g)达到平衡时,有的CO转化为CO2。在条件相同时,若将1molCO和2molH2O(g)充入同一反应器中,当反应达到平衡后,混合气体中CO2的体积分数可能为
CO2(g)+H2(g)达到平衡时,有的CO转化为CO2。在条件相同时,若将1molCO和2molH2O(g)充入同一反应器中,当反应达到平衡后,混合气体中CO2的体积分数可能为
A.22.2% B.28.2% C.33.3% D.37.8%
[解析] 对于后一气态反应来说,无论反应如何进行,物质的量总是3mol,生成的CO2最多不能达到1mol,最少不低于mol,故CO)的体积分数在33.3%与22.2%之间。选D。
[借鉴意义] 十字交叉法是有关混合物的计算中一种常用的解题方法,它能将一元一次方程或二元一次方程组求解转化成简单的算术运算,如果你对十字交叉法没有把握,这时候完全可以列一个二元一次方程组来代替十字交又法,这样的把握性会比较大。十字交叉法只能作为一种计算的技巧,而不是一种化学方法, 在例题12中,采用了"归中原理"判断法。"归中原理"基本思路有两条:其一,"取两端、选中间",先将问题假设成极限状态进行分析,求出两端极值,据此确定可能的取值范围,凡确定范围的习题均可用此法;其二是"定中间,选两头",如例题10,先确定平均值,再根据"有一大必有一小"的平均原理使问题轻易得解。所谓平均值法是一种将数学平均原理应用于化学计算的解题方法。它所依据的数学原理是:两个数M1和M2(M1>M2)的算术平均值M一定介于二者之间,即M1>M>M2。所以,只要求出平均值M,就可知道M1和M2的取值范围,结合题给条件即可迅速求出答案。
题型七 极端分析法
[例题13] 将某碱金属M及其氧化物M2O的混合物4g投入足量水中,待反应后蒸干得5g碱,则这种碱金属为
A.Li B.Na C.K D.Rb
[解析] 假设4g为碱金属单质,与水反应生成5g碱,则:
2M + 2H2O === 2MOH + H2↑
2M 2(M+17)
4g xg
x==4(M+17)/M。由题可知:4(M+17)/M > 5即:M<68.
假设4R为碱金属氧化物,与水反应生成5g碱,则:
M2O + H2O === 2MOH
2M+16 2(M十17)
4 g y g
y==4(M+17)/(M+8)。 由题可子:4(M+17)/(M+8)<5即:M>28.
而相对于原子质量介于28与68之间的碱金属只有钾,故选C。
[例题14] 含ngHNO3的稀溶液与m g铁粉充分反应,铁全部溶解,生成NO气体。已知有n/4 gHNO3被还原,则n :m可能是
A.1:1 B.2:1 C.3:1 D.4:1
[解析] 由题意可知,未被还原的硝酸的质量为n-n/4==3n/4(g)。因此本题可以采用极限法进行分析:
①假设铁的氧化产物只有Fe(NO3)2时,则n(Fe2+):n(NO3-)==1:2
即:(m/56):(3n/4÷63)==1:2求得n:m==3:1
②假设铁的氧化产物只有Fe(NO3)3时,则n(Fe3+):n(NO3-)==1:3
即:(m/56):(3n/4÷63)==1:3求得n :m==9:2
③当铁的氧化产物为Fe(NO)2、Fe(NO3)3的混合物时,则3:1<n:m<9:2则由题
意可知,凡是符合3:l≤n:m≤9:2,均可选。故本题选CD。
[借鉴意义] 极端分析法就是从某种极限的状态出发,进行分析、推理、判断的思维方法。先根据边界条件确定答案的可能取值范围,然后结合题给条件得到正确答案。
基础2题型训练
1.写出各步反应的方程式,然后逐一递进找出关系式;
0.0025mol,w(S)==×100%==36%.故选B。
[借鉴意义] 关系式法是根据化学方程式计算的主要方法。对于多步反应体系,依据若干化学反应方程式,找出起始物质与最终物质的量的关系,可以使多步计算化为一步而完成。找关系式的方法,一般有以下两种:
0.50mol·L-l的NaOH溶液完全中和,则原化合物中硫元素的质量分数为
A.45% B.36% C.20% D.40%
[解析] S-H2SO4-2NaOH n(S)==n(NaOH)==×0.010L×0.50mol·L-1==
3.确定样品中杂质的成分。
题型三 估算法
[例题6] 常温下,将10g下列固体与90g水充分混合,所得溶液里的溶质的质量分数最小的是
A.CuSO4·5H2O B.Na2O C.CaO D.KNO3
[解析] CaO与H2O反应生成Ca(OH)2,Ca(OH)2属微溶物,其溶解度在0.01 g-1 g之间,而其他物质均易溶于水,选C。
[例题7] 要使400g10%的NaCl溶液中溶质的质量分数增大一倍,下列有关方法及数据中正确的是
A.蒸发掉180g水 B.蒸发掉200g水
C.加入50gNaCl D.加入40gNaCl
[解析] 估算。从分式的分子、分母的变与不变不难看出,要使溶液中溶质质量分数增大一倍,需蒸发掉原溶液质量一半的溶剂(蒸发过程中,溶质质量--分子不变,而分母变为-半时,比值扩大一倍);而采用加入溶质的方法时,所加溶质质量也应比原溶液中溶质质量略大一些。借此结论可直接判断出B正确,且粗略判断出在C、D中C正确。故选BC。
[借鉴意义] 加快解题速度,要改变见到数字题就动笔计算的习惯,有些题型"貌似计算,实则可测",解题的关键往往利用多动脑少动笔,通过推理、猜测从有关概念着手,充分利用边界条件、极限、始终态等,即可速算、巧算,甚至无须计算就可以迅速准确地估算答案、如例题6就是抓住Ca(OH)2本身的溶解性来进行估算的。估算法虽可大大提高解题效率,但其使用范围有一定的局限性,绝大多数计算题是不能用估算法解决的。尝试用估算法解题是好的,但面对每一个题都想用估算法解决,有时也会贻误时间。
题型四 关系式法
[例题8] 在O2中燃烧0.22g硫和铁组成的化合物,使其中的硫全部转化为SO2,
将这些SO2全部转化为SO3,生成的SO3完全被H2O吸收,所得H2SO4可用10.0 mL
2.根据质量分数确定化学式;
1.c、w、ρ间的相互转化;
0.026×0.05×u=0.026×0.1×2,u=4,分子最简式为RO2;由最简式公式得:==1:2,M≈l40。应选A。
[例题4] 室温下,用惰性电极电解ymL某二价金属的硫酸盐溶液-段时间后,阴极有m mg金属析出,溶液的pH由6.5变为2.0(电解前后溶液体积的变化可忽略不计),析出金属的原子量的数字表达式为
A. B. C. D.
[解析] 该二价金属的物质的量为,电路上流过的电子的物质的量为×2。此电解为混合电解,故产生的H+的物质的量即为电子的物质的量× 2,由此可得:×2==10-2×V,M==。应选A。
[借鉴意义] 运用守恒法解题,就是利用在物质变化过程中,某一特定的量固定不变(如质量守恒,正负化合价守恒,元素守恒,电子得失守恒,溶液中的电荷守恒等)而进行化学计算的解题方法。它是从整体宏观的角度出发,抓住题目内在的守恒关系,避开繁杂的计算,从而快、准、稳地得到答案。比如例题3就是利用电荷守恒,例题2就是利用电子得失守恒。
题型二 设一法
[例题5] 相同质量的N9、Mg、Al分别与盐酸反应,(1)若盐酸足量时,生成的氢气的质量比是__________________
A.Na>Mg>Al B.Na>Mg=Al
C.Na=Mg=Al D.Na<Mg<Al
[解析] (1)若盐酸足量:设Na、Mg、Al质量均为1 g,则根据关系式
2Na - H2↑ Mg - H2↑ 2Al - 3H2↑
2×23 2 24 2 2×27 3×2
1 1/23 1 1/12 1 1/9
则氢气的质量比是(1/23):(1/12):(1/9)==36:69:92Z,
(2)若盐酸不足,三种金属都足量时,足量的Mg、Al与不足量的等量的盐酸反应产
生的氢气质量相等,而足量的钠能继续与水反应,则产生的氢气最多。应选B。
[借鉴意义] 抽象问题具体化,是一种简单又实用的小技巧,由于"1"是最简单的数字,"质量相等"时常设其质量均为1g,故又称为"设一法"。设一法是赋值法的一种,是解决无数值或缺数值计算的常用方法。遇到下列情况,可用设一法:
8.类比递推选择题。
基础2 定量分析选择题
定量分析选择题又称计算选择题,在高考试题中约占15%-20%,是同学们比较"怕"的一种题型。究其原因,主要是求解选择题的方法欠妥,惯用常规方法处理,结果是"小题大做"。对于定量型选择题,如果不运用简便可行的方法,往往会影响到解题的速度和答案的准确性。所以要简化数字运算或不用数字运算,集讨论、分析、判断、推理和计算于一体,加强思维能力和解题技巧的训练,强化"综合智力",运用巧解方法。
典型题型与例题
题型一 守恒法
[例题1] 已知某H2SO4、FeSO4、Fe2(SO4)3混合溶液100mL,其中阳离子浓度相等,SO42-浓度为6mol/L,此溶液中还可溶解铁粉的质量为
A.11.2 g B.16.8 g C.33.6g D.5.6 g
[解析] 根据电荷守恒,可得:c(H+)+2c(Fe2+)+3c(F3+)==2c(SO42-)。又由于c(H+)==c(Fe2+)==c(Fe3+),则6c(H+)==2×6mol/L,c(H+)==2mol/L。能溶解铁粉的质量为:(2mol/L×0.1 L×0.5+2mol/L×0.1 L×0.5)×56g/mol==11.2 g。应选A。
[例题2] 某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合液,经测定ClO-和ClO3-个数比为1:2,则Cl与KOH溶液反应时,被还原的氯与被氧化的氯的物质的量之比为
A.21:5 B.4:1 C.3:l D.11:3
[解析] 设ClO-为x个,由题意知,ClO3-为2x个,生成它们要失去电子共11x个,由电子得失守恒知必有11x个Cl-生成。所以被还原的氯与被氧化的氯的原子个数比为11x:(x+2x)==11:3。应选D。
[例题3] 有一含杂质4.2%的某稀土元素的氧化物样品,其中含该稀土元素的质量分数为78%;在26mL0.05mol/L的该稀土元素的硫酸盐溶液中,加入0.1 mol/LBaCl2溶液26mL时,可使其中的SO42-完全沉淀,则该稀土元素的相对原子质量为
A.140 B.114 C.70 D.105
[解析] 设该稀土元素的硫酸盐中正价总数为u,则根据总价数相等关系可得:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com