
20.(1)1s22s22p63s23p63d104s24p3
(1分) As(1分)(2) (1分)氧(1分)(3)三角锥(2分)
(1分)氧(1分)(3)三角锥(2分)
(4)As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O(2分) (5) NH3>AsH3>PH3 (2分) NH3可形成分子间氢键,沸点最高,AsH3相对分子质量比PH3大,分子键作用力大,因而AsH3比PH3沸点高。(2分)
17. (1) MnO2 + 4 H++2 C1- = Mn2++C12↑+2H2O(2分) 产生有毒的氯气(2分)
(2) 将Fe2+转化为Fe3+ (2分)
(3) C (1分)Fe(OH)3(1分)
(4) 3.7<pH<8.3 (2分)
使Fe3+完全沉淀(1分),并防止Mn2+转化为Mn(OH)2沉淀(1分)
(5) Mn2++H2O2+2OH- MnO2↓+2H2O(2分)
MnO2↓+2H2O(2分)
(1)①提高原料的利用率,减少污染物的排放(2分);3:7(2分)
②加水会将溶液稀释,不利于将滤液蒸发浓缩(2分)
③由于Cu2+发生水解:Cu2++2H2O Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解(2分)
Cu(OH)2+2H+,加入硝酸可以抑制硝酸铜的水解(2分)
(2)b d(2分)
(3) Cu+2N2O4=Cu(NO3)2+2NO↑(2分)
 19:
19:
 (1)CH3CHO (1分)(2)取代反应(1分)
(1)CH3CHO (1分)(2)取代反应(1分)
 (3)(2分)
(3)(2分)

 (4)(2分)
(4)(2分)
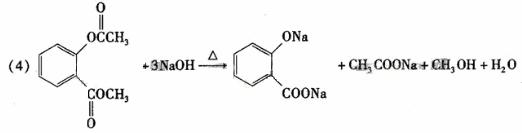
 (5)a、b、d(2分)
(5)a、b、d(2分)
(6)(4分)
16.(1)6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2、10NA;(2)HI具有还原性,能将已生成的碘酸氢钾还原;(3)Cl2能将KIO3氧化成KIO4;(4))蒸发结晶;(5)I-+6OH--6e-=IO3-+2H2O;
15.⑴用冰水冷却有利于析出更多的晶体,黑暗可以防止晶体分解(2分)
⑵过滤、洗涤(2分)
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O(2分)
⑶100mL容量瓶、酸式滴定管(2分) ⑷3 (2分)
20、(12分)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是__________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(5)X的氢化物与同族第二、第三周期元素所形成的氢化物的沸点高低是______________并说明理由____。
南京市第九中学2010届十月高三学情分析试题
|
选择题
非选择题
19、(12分)

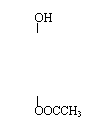
 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:

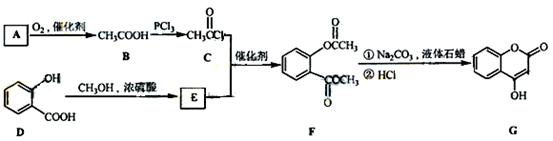

 (1)A与银氨溶液反应有银镜生成,则A的结构简式是
。
(1)A与银氨溶液反应有银镜生成,则A的结构简式是
。
 (2)B→C的反应类型是
。
(2)B→C的反应类型是
。
 (3)写出满足下列条件的E的同分异构体的结构简式 。
(3)写出满足下列条件的E的同分异构体的结构简式 。
 ① 苯环上的一取代产物只有两种;
① 苯环上的一取代产物只有两种;
② 能发生银镜反应;
 ③ 能与FeCl3溶液发生显色反应。
③ 能与FeCl3溶液发生显色反应。
 (4)写出F和过量NaOH溶液共热时反应的化学方程式:
(4)写出F和过量NaOH溶液共热时反应的化学方程式:

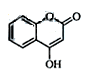
 (5)下列关于G的说法正确的是( )
(5)下列关于G的说法正确的是( )
 a.能与溴单质反应
b. 能与金属钠反应
a.能与溴单质反应
b. 能与金属钠反应
 c. 1molG最多能和3mol氢气反应
d. 分子式是C9H6O3
c. 1molG最多能和3mol氢气反应
d. 分子式是C9H6O3
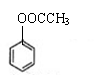
(6)请设计合理的方案以苯酚和乙醇为原料合成乙酸苯酯
(用合成路线流程图表示,并注明反应条件)。
提示:①合成过程中无机试剂任选;
②合成路线流程图示例如下:
 CH3CH2OH
CH3CH2OH
 H2C=CH2
BrH2C-CH2Br
H2C=CH2
BrH2C-CH2Br
18.(12分)(1)工业上以粗铜为原料采取如下图所示流程制备硝酸铜晶体:


①在步骤a中,需要通入氧气和水,其目的是 。现有1L NO2、NO混合气体NOx,将其氧化成HNO3,需同温同压下O2的体积0.6L,则混和气体中NO2、NO的物质量之比为 。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,不用加水的方法调节溶液pH的原因是 。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明) 。
(2)下图是某小组同学查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O ]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是 (填字母)。
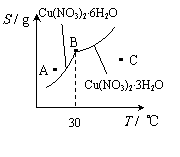 a. A点时的溶液为不饱和溶液
a. A点时的溶液为不饱和溶液
b. B点时两种晶体可以共存
c. 按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2·6H2O晶体
(3)某些共价化合物(如H2O、NH3、N2O4等)在液态时有微弱的导电性,主要是因为发生了电离,如:2NH3 NH
NH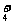 +NH
+NH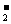 ,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18, Cu与液态N2O4反应制得无水硝酸铜的化学方程式是 。
,由此制备无水硝酸铜的方法之一是用Cu与液态N2O4反应。液态N2O4电离得到的两种离子所含电子数相差18, Cu与液态N2O4反应制得无水硝酸铜的化学方程式是 。
17.(14分)回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、NH4Cl和炭黑等),由锰粉制取MnO2的步骤如下图所示:
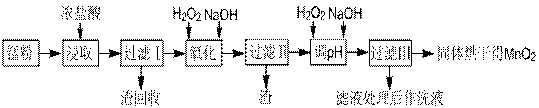
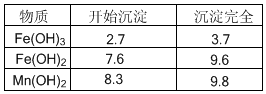
根据上图所示步骤并参考左边表格数据回答问题:
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等。MnO2与浓盐酸反应的离子方程式为 ;这种处理方法不足之处为: 。
(2)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是__________________________。
(3)过滤I的滤渣的化学式为 。过滤Ⅱ的滤渣的化学式为 。
(4)将过滤I所得滤液经H2O2氧化后,再加入NaOH溶液调节pH的范围是: ,其目的是 。
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离于方程式为__________________________________________。
16.(12分)碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平)

(1)在反应器中发生的反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平),生成两种还原产物所得电子数目相同,请写出已配平的该反应的化学方程式:_____________________________________。若有1 mol I2完全反应,则该反应中转移电子的数目为________(设NA表示阿伏加德罗常数)
(2)步骤②中,用硝酸而不用HI,其原因可能是________________________。
(3)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为________。
(4)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是___________。
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
(5)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O=KIO3+3H2↑,则阳极的电极反应式为:___________________________。
15.(10分)化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏材料,实验室可以用如下的方法来制备这种材料并测定这种材料的组成。
Ⅰ.制备
 K2C2O4
K2C2O4
FeCl3
⑴结晶时应将溶液用冰水冷却并在黑暗处等待晶体的析出,这样操作的原因是:________________________________________________________________。
⑵操作Ⅲ的名称是___________。
Ⅱ.组成测定
称取一定质量的晶体置于锥形瓶中,加入足量的蒸馏水和稀H2SO4,将C2O42-转化为H2C2O4后用0.1000 mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液24.00mL时恰好完全反应;再向溶液中加入适量的还原剂,恰好将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00mL。第二次滴定的离子化学方程式为:_______________________________________________________
⑶配制100mL 0.1000 mol·L-1KMnO4溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有_______________________________(填仪器名称)。
⑷该化合物KxFe(C2O4)y·3H2O中,x=_______。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com