
2.生产、生活中的有些现象看上去很相近,但原理相差甚远。下列现象中产生原理相同的是
A.在两只烧杯中分别放置干冰和浓硝酸,都有白雾产生
B.碘和锌在少量水作用下剧烈反应,钠在氯气中燃烧,都有烟产生
C.铁酸钾(K2FeO4)和氯化亚铁与氯水的混合物,都可用于自来水消毒及净化
D.在空气中亚硫酸钠与偏铝酸钠都会变质
1.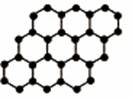 石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是
石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如下),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是
A.石墨烯与石墨互为同位素
B.0.12g石墨烯中含有6.02×1022个碳原子
C.石墨烯是一种有机物
D.石墨烯中的碳原子间以共价键结合
21.(10分)
(1)
(2) ,
20.[方法一]加热转化法
(1)
(2)
(3)
 [方法二]测 SO2质量法
[方法二]测 SO2质量法
(1)
(2)
[方法三]测沉淀质量法
(1)
(2)
19.(10分)
(1)
(2)
(3) , (4) , (5) 。

18.(10分)
(1)
(2)
(3)
(4)
 (5)①
②
③
(5)①
②
③
17.(8分)
(1)
 (2)
, (3)
, (4)
。
(2)
, (3)
, (4)
。
21.将不同质量的某均匀铁铜合金分别加入到相同浓度200 ml的稀硝酸中,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO)。
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
合金质量 / g |
m1 |
5.28 |
7.92 |
10.56 |
13.20 |
|
剩余金属质量 / g |
0 |
0 |
0.96 |
3.84 |
6.48 |
|
NO体积 / L |
V1=0.448 |
V2 |
V3 |
V4 |
V5=1.792 |
试通过计算填空:
(1)写出实验⑤中发生的离子反应方程式: ;
(2)硝酸的物质的量浓度为 ;
(3)通过计算确定实验④中剩余的金属成份是什么?
(4)通过计算确定合金中铁铜的物质的量之比为多少?
(5)通过计算确定实验①中m1的质量为多少?(要求写出计算过程)
岳阳市一中2010届高三第二次质量检测
|
 化学答题卷
化学答题卷 20. 某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数
[方法一]加热转化法
称取a克样品,置于硬质玻璃管中通入氧气加热一段时间。
(1)则硬质玻璃管中可能发生的化学反应方程式为 ;
(2)若冷却后称得固体质量为b克,则样品中Na2SO4质量分数为 ;
(3)该方法的缺点是 。(只要答一点)
[方法二]测 SO2质量法
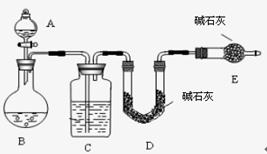
采用如图所示装置,通过实验测定生成SO 2的质量。
(1)若打开A装置的活塞时发现液体不能顺利留下,若装置无堵塞,则可能的原因是
。
(2)若实验前称取c克样品,测得SO2的质量为d克,则可求出Na2SO4质量分数,该方法的缺点是 。(只要答一点)
[方法三]测沉淀质量法
第一步:称取e克样品,置于小烧杯中;
第二步:向小烧杯中加入足量稀盐酸,加热;
第三步:向小烧杯中加入足量BaCl2溶液,然后过滤、洗涤;
第四步:干燥沉淀,称重为f克。
(1)方案中BaCl2不能改成Ba(NO3)2,试简述原因 。
(2)简述洗涤沉淀的方法:
。
19.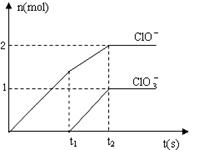 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反 应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反 应(发生的反应均为放热反应)。生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
(1)t1时,Ca(OH)2与Cl2发生反应的总的离子方程式为
。
(2)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为:
。
(3)该石灰乳中含有Ca(OH)2的物质的量是______ mol。
(4)据分析,生成Ca(C1O3)2的反应是由温度升高引起的,通入Cl2的速度不同,C1O-和C1O3-的比例也不同。
若在原石灰乳中通入氯气的速度加快,则反应后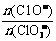 _____2(填“>”、“<”或“=”);
_____2(填“>”、“<”或“=”);
若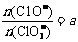 ,则n(C1-)=
mol(用含a的代数式来表示)。
,则n(C1-)=
mol(用含a的代数式来表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com