
15.(每空2分,共10分)
(1)取少量反应后的混合液于试管中,滴入几滴淀粉溶液,若溶液未变蓝,则证明碘已完全反应;反之,则未完全反应
(2)隔绝空气分离(或其他合理答案)
(3)①250 mL容量瓶、酸式滴定管 ② 95.00% ③样品在空气中被氧化(或样品在空气中吸水)
21.(8分)将23.9g表面已锈蚀成铜绿[Cu2(OH)2CO3]的铜片投入120mL一定浓度的硝酸中;充分反应后,硝酸被还原成NO2和NO,测得反应后溶液PH值为1。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤,干燥后得到29.4g蓝色固体。(假设反应前后溶液的体积不变)
计算:(1)已锈蚀的铜片中的铜元素的质量分数为 ▲ 。(保留两位小数)
(2)求铜片中单质铜的物质的量。(写出计算过程)
(3)若生成NO2和NO混合气体共aL(S.P.T)。
①a的取值范围为 ▲ 。
②原硝酸的浓度为多少?(只需用a的代数式表示,写出过程)
化 学
参考答案及评分标准
选择题
非选择题
20.(11分)磷单质及其化合物的有广泛应用。
(1)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) △H
①上述反应中,副产物矿渣可用来 ▲ 。
②已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) △H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g) △H2
SiO2(s)+CaO(s)=CaSiO3(s) △H3
 用△H1、△H2和△H3表示△H,△H= ▲
用△H1、△H2和△H3表示△H,△H= ▲
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见右图)之间脱去两个水分子的产物,其结构式为 ▲ 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 ▲
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为 ▲ 。
②化学镀镍的溶液中含有Ni和H2PO,在酸性等条件下发生下述反应:
(a) ▲ Ni2+ + ▲ H2PO + ▲ →▲ Ni+ + ▲ H2PO + ▲
(b)6H2PO+2H+ =2P + 4H2PO + 3H2↑
请在答题卡上写出并配平反应式(a)。
③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点: ▲ ;
原理上的相同点: ▲ ;
化学镀的优点: ▲ 。
19.(10分)工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化:
2SO2(g)+O2 (g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是 ▲ (填字母)。
A.向装置中充入N2
B.向装置中充入过量的O2
C.使用更高效的催化剂
D.升高温度
(2)在一密闭容器中充入4 mol SO2和一定量O2,当放出353.6 kJ热量时,SO2的转化率最接近于 ▲ (填字母)。
A.40% B.50% C.80% D.90%
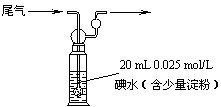 (3)580℃时,在一密闭容器中充入一定量的SO2和O2,当反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3 mol·L-1、8.0×10-3 mol·L-1和4.4×10-2 mol·L-1。该温度下反应2SO2(g)+O2 (g)
(3)580℃时,在一密闭容器中充入一定量的SO2和O2,当反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3 mol·L-1、8.0×10-3 mol·L-1和4.4×10-2 mol·L-1。该温度下反应2SO2(g)+O2 (g) 2SO3(g)的平衡常数K= ▲ 。
2SO3(g)的平衡常数K= ▲ 。
(4)硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需要加以处理后才能排放。现用右图所示装置测定尾气中SO2的含量,当通入尾气11.2 L(标准状况下测定)时,碘水恰好褪色。通过计算说明,该尾气能否直接排放(写出计算过程)。 ▲
18.(10分)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
K2FeO4在处理水的过程中所起的作用有 ▲ 。
(2)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-) =1.0 mmol·L-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。该实验的目的是 ▲ ;发生反应的△H ▲ 0(填“>”、“<”或“=”)。
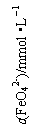


(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是 ▲ (填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:
HFeO4-+OH-=FeO42-+H2O
(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤3:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤4:加入二苯胺磺酸钠作指示剂,用c mol·L-1 (NH4)2Fe(SO4) 2标准溶液滴定至终点,消耗(NH4)2Fe(SO4) 2溶液V1 mL。滴定时发生的反应为:
Fe2++Cr2O72-+H+→Fe3++Cr3++H2O(未配平)
① 写出步骤2中发生反应的离子方程式 ▲ 。
② 根据上述实验数据,测定该溶液中K2FeO4的浓度为 ▲ mol·L-1(用含字母的代数式表示)。
17. (10分)21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
(10分)21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
已知:
① Mg(s)+Cl2 (g)=MgCl2 (s) △H=-641 kJ·mol-1
② Cl2(g)+1/2Ti (s)=1/2TiCl4 (l) △H=-385 kJ·mol-1
(1)钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。TiO2+发生水解的离子方程式为 ▲ 。
 (2)反应Ⅰ在800-900℃下进行,还生成一种可燃性无色气体,该反应的化学方程式为 ▲ ;反应Ⅱ的热化学方程式为 ▲ 。
(2)反应Ⅰ在800-900℃下进行,还生成一种可燃性无色气体,该反应的化学方程式为 ▲ ;反应Ⅱ的热化学方程式为 ▲ 。
(3)该工艺流程中,可以循环使用的物质有 ▲ 。
(4)在800℃-1000℃时电解TiO2也可制得海绵钛,装置如右图所示。图中b是电源的 ▲ 极,阴极的电极反应式为 ▲ 。
16.
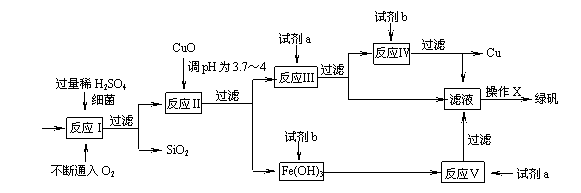 (8分)以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:
(8分)以黄铜矿(主要成份为CuFeS2,含少量杂质SiO2等)为原料,进行生物炼铜,同时得到副产品绿矾(FeSO4·7H2O)。其主要流程如下:
|
已知:① 4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O
② 部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下表
|
沉淀物 |
Cu(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
|
开始沉淀pH |
4.7 |
2.7 |
7.6 |
|
完全沉淀pH |
6.7 |
3.7 |
9.6 |
(1)试剂a是 ▲ ,试剂b是 ▲ 。
(2)操作X应为蒸发浓缩、 ▲ 、 ▲ 。
(3)反应Ⅱ中加CuO调pH为3.7-4的目的是 ▲ ;
(4)反应Ⅴ的离子方程式为 ▲ 。
15. (10分)碘化钠是实验室中常用的分析试剂,也常用于医疗和照相业。工业上用铁屑还原法制备NaI,其主要流程如下图,请回答下列问题:
(10分)碘化钠是实验室中常用的分析试剂,也常用于医疗和照相业。工业上用铁屑还原法制备NaI,其主要流程如下图,请回答下列问题:
(1)判断碘是否已完全反应的实验方法是 ▲ ;
(2)将滤液在低温下分离出NaI样品的过程中,要防止NaI被氧化,最好采取的措施是 ▲ ;
(3)测定产品中NaI含量的方法是:
a.称取3.000 g样品、溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用0.1000 mol/LAgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为19.00 mL。
① 上述测定过程所需仪器中,需要检查是否漏液的仪器有 ▲ 。
② 上述样品中NaI的质量分数为 ▲ 。
③ 若用上述方法测定产品中NaI的质量分数偏低(测定过程中产生的误差忽略不计),其可能原因有 ▲ 。
14.将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产生全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A.开始加入合金的质量可能为6.4g
B.参加反应的硝酸的物质的量为0.1mol
C.生成沉淀完全时消耗NaOH溶液的体积为100mL
D.溶解合金时收集到NO气体的体积为2.24L
非选择题
13.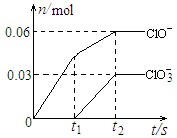 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示。下列说法正确的是
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示。下列说法正确的是
A.苛性钾溶液中KOH的质量是4.94g
B.反应中转移电子的物质的量是0.21mol
C.氧化性ClO-<ClO3-
D.ClO3-的生成是由于温度升高引起的
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com