
第二节 胶体的性质及其应用
4、将某溶液逐滴加入Fe(OH)3溶液胶内,开始时产生沉淀,
继续滴加时沉淀又溶解,该溶液是( )
A、2mol/L H2SO4溶液 B、2mol/L NaOH溶液
C、2mol/L MgSO4溶液 D、硅酸溶胶
Ⅴ、布置作业[作业]课本P79 NO 1、2、3、4
3、解释下列问题
⑴FeCl3为什么可作止血剂?
⑵含氮量相同的硝铵和硫铵,硝铵的肥效不及硫铵,这是什
么缘故。
2、用FeCl3溶液制Fe(OH)3胶体时
⑴为什么不能过渡加热?
⑵为什么不能直接加热FeCl3溶液?
⑶为什么不能用井水?
Ⅰ、复习课文
[提问]1、胶体和溶液的本质区别是什么?
2、怎样鉴别Fe(OH)3胶体与Fe(SCN)3溶液?
Ⅱ、引入新课
[引言]从外观看,胶体跟溶液并没有明显区别。那么,怎样来鉴别
胶体和溶液呢?下面介绍胶体的几种重要性质,其中某些性
质可用来鉴别胶体和溶液。
Ⅲ、讲授新课
[揭题]二、胶体的重要性质
[实验]让一束光照射盛有Fe(OH)3胶体与Fe(SCN)3溶液的试管
[小结]1、丁达尔现象
操作:强光照射,侧面观察
现象:出现一条光亮的通路
原因:胶体微粒对光线的散射而形成
应用:鉴别胶体和溶液
[过渡语]丁达尔现象有何应用呢?超倍显微镜就是利用了胶体发生
丁达尔现象这个性质--因为每个微粒都发生了散射现
象,就如无数个小发光体,使我们能够看到这些小发光体
的大小、形状及其“动”的形象。
它是怎样“动”的呢?这就是布朗运动。
[小结]2、布朗运动
特点:永恒、不规则
原因:胶粒(小而轻)受分散剂的(无规则运动)的撞击。
[过渡语]既然胶粒在“动”,那么它们相互碰撞到一起,不能结合
成较大颗粒而沉淀吗?事实上胶体都比较稳定,并不沉
淀,这是为什么?
[实验]用Fe(OH)3胶体做电泳实验
[小结]3、电泳
现象:阴极附近颜色加深
阳极附近颜色变浅
推测:Fe(OH)3胶体的微粒带正电荷
[讨论]Fe(OH)3胶粒为何带上正电荷?
[讲解]当物质分散成胶体的微粒时,分散质的总表面积有很大的增
加。例如,若一个西瓜的表面积为4πR2,用刀切成二半,
总面积就增加2πR2。
胶粒直径 表面积 吸附力 选择性吸附 胶粒带上 带电粒子向两极

 小 →
大 → 强 → 离子 → 电荷 游去 电泳
小 →
大 → 强 → 离子 → 电荷 游去 电泳
[小结]胶粒的带电规律
[谈话]电泳原理在工业上有许多应用。如浙江陶瓷厂除去陶土中
Fe2O3杂质,浙江电除尘器厂生产的电除尘器除去大量烟尘,
以减少污染等。
[提问]在一定时间内,胶体为什么能够稳定存在?
[讲解]在同一胶体溶液里,同一种胶粒只吸附同种离子而带上同种
电荷,同种胶粒相互排斥因而不易聚集,故胶体具有较大的
稳定性。
[过渡语]既然胶体稳定性是因为胶粒带电,那么胶粒失去电荷,会
有什么变化呢?
[追问]胶粒失去电荷后,胶粒碰撞后结合成较大的颗粒而发生凝
聚。那么有什么办法除消胶粒所带的电荷呢?
[讨论]
[实验]Fe(OH)3胶体+MgSO4溶液→红褐色↓
|
|
 Fe(OH)3胶粒○ Fe(OH)3胶粒 沉淀
Fe(OH)3胶粒○ Fe(OH)3胶粒 沉淀

 MgSO4=Mg2++SO
MgSO4=Mg2++SO 不再带电
不再带电
[结论]电解质能使胶体凝聚
[提问]早餐时,在热豆浆里加入酱油或白糖有何不同现象?为什么?
|
 [实验]Fe(OH)3胶体
[实验]Fe(OH)3胶体
H4SiO4胶体
|
|
|
|

H4SiO4胶粒○ H4SiO4
[结论]带相反电荷的胶粒混和会使胶体凝聚
[谈话]两瓶不同品种的墨水混和有可能发生凝聚,从而堵塞钢笔的
笔孔,造成出水不畅。从这个意义上看,墨水不宜互相借用。
[提问]加热对布朗运动有何影响?对胶粒与离子之间的结合力又有
|
 [实验]H4SiO4胶体 白色↓
[实验]H4SiO4胶体 白色↓
[结论]加热能使胶体凝聚
|
|


 胶体
胶体
离子吸咐力减弱 相互结合
[谈话]美国曾经制成一种“微波手术刀”,这种刀能发出微波把割
口附近的血液中的蛋白质“加热”,使血液凝固,减少流血。
[小结]4、凝聚

 加入电解质力
沉淀
加入电解质力
沉淀
 胶体
加入某些胶体→胶粒失去电荷→凝聚→
胶体
加入某些胶体→胶粒失去电荷→凝聚→
加热 凝胶
[追问]胶体凝聚的结果是否一定产生沉淀呢?
|
 [实验]H4SiO4胶体 凝胶
[实验]H4SiO4胶体 凝胶
[谈话]中国人民食用2千多年,现在国外也闻名的食品--豆腐,
就是把盐卤或石膏溶液加入豆浆里,使豆浆里的蛋白质和水
等物质一起凝聚而制成的一种凝胶。
[提问]点豆腐时为什么用MgCl2或CaSO4呢?
[讲解]这是因为蛋白质胶粒一般带负电荷,Ca2+、Mg2+比Na+的正电荷高,凝聚能力强,如用食盐点豆腐,因NaCl加得过多而使豆腐太咸,就不能食用了。
[过渡语]至此,我们已经对胶体的概念和胶体的几种重要性质有了初步的了解。那么,胶体的知识有什么重要意义呢?
[小结]三、胶体的应用
①土壤的保肥作用 ②制豆腐 ③明矾净水
④电除尘 ⑤三解洲的形成
Ⅳ、巩固新课
[练习]1、胶体的性质中哪些跟胶粒直径大小有关?
哪些跟胶粒的带电性质有关?
3、德育渗透:适当进行辩证唯物主义观点的教育和爱国主
义的教育。
[重点]胶体的重要性质
[教具]多媒体
[教法]实验探究法
[目标] 1、知识传授:⑴初步认识胶体的重要性质
⑵一般了解胶体凝聚方法
2、能力培养:通过实验,培养学生的观察能力、思维能力
以及想象能力。
第2课时
[讨论]上述①、②、③号试管中的溶液、胶体与浊液是怎样形成的?
其形成过程有什么共同的特点?
 [小结] 一种或几种物质的微粒 + 另一种物质
混和物
[小结] 一种或几种物质的微粒 + 另一种物质
混和物
 分散质 + 分散剂 分散系
分散质 + 分散剂 分散系
[提问] 上述①、②、③号试管中液体,分散质、分散剂各是什么?
[讨论]刚才实验时同样的反应物,②中无沉淀,③中有沉淀,这是
什么原因呢?
[小结] AgNO3+KI=KNO3+AgI↓
AgNO3+KI=KNO3+AgI(胶体)
浓→快→多→颗粒大→有沉淀--浊液
稀→慢→少→颗粒小→无沉淀--胶体
[设问]大家知道,分散质的颗粒溶液小,而浊液大。这可以通过过
滤实验加以证明,前者可透过滤纸,后者则不能。那么胶体
中的分散质颗粒的大小又如何呢?能否设计出类似的实验来
证明呢?
|
|


|
 过滤 滤出液
过滤 滤出液
AgNO3
|
 碘水
碘水


|
AgNO3
[小结]淀粉胶粒和溶液里的离子或分子都能通过滤纸。
[追问]现把滤纸换成半透膜,胶粒能否透过半透膜呢?
[讨论]⑴要证明食盐水里的Na+、Cl-能否透过半透膜,需要什么试
剂?所取试液是半透膜内还是半透膜外的液体?为什么?
⑵同样,如何证明淀粉胶体的微粒能否透过半透膜?
|
|
 取膜外的液体 白色↓→说明膜外有Cl-
取膜外的液体 白色↓→说明膜外有Cl-
 取膜外的液体 焰色反应 黄色→说明膜外有Na+
取膜外的液体 焰色反应 黄色→说明膜外有Na+
⑵证明淀粉胶粒不能透过半透膜
 取膜外的液体 碘水 不变蓝色→说明膜外无淀粉
取膜外的液体 碘水 不变蓝色→说明膜外无淀粉
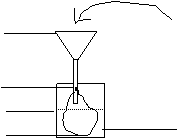 [实验]
[实验]
小漏斗 食盐水
漏斗架 淀粉胶体
绳 子
烧 杯
半透膜 蒸馏水
[小结]实验证明:胶体微粒大于溶液里溶质的离子或分子。进一步实验证明其直径大小在10-9--10-7米之间。这是胶体区别于其它分散系的本质特征。
胶体的本质
分散质微粒的直径大小在10-9--10-7米之间的分散系叫胶体。
 溶液 胶体 浊液
溶液 胶体 浊液
10-9m 10-7m D
[讲解]把混有离子或分子杂质的胶体装入半透膜的袋里,并把这个袋放在溶剂中,从而使离子或分子从胶体溶液里分离的操作叫做渗析。应用渗析的方法可精制某些胶体。
[提问]由实验你可知道普通滤纸的细孔直径范围多大?而半透膜的
孔径又是多大?
[小结] (二)胶体的提纯 渗析
|
|
过 滤 |
渗 析 |
|
    含 义 含 义使用用具除去杂质提纯对象应用实例 |
把不溶于溶剂的固体物质跟溶液分离的一种操作。 滤纸和小漏斗 固体小颗粒(许多分子的聚集体) 浊液 Fe(OH)3↓+NaCl溶液 |
将杂质离子或分子跟液溶胶分离的一种操作。 半透膜 单个分子或离子 液溶胶 Fe(OH)3(胶体)+稀HCl溶液 |
|
|
小孔直径 |
10-7m< D |
D
<10-9m |
|
[谈话]过滤、渗析实验好像渔民用渔网打鱼一样,小鱼穿网而过,溜之大吉,而大鱼则在劫难逃了。当然,不同的渔网,网眼大小不同,故从网中可以漏出大小不同的鱼。滤纸孔径大,不仅可以漏出溶液中的单个离子或分子,也可以漏出胶体颗粒。但是半透膜的孔径太小了,只能漏出溶液中的单个离子或分子,而胶粒则无法漏出。
[设问]胶体是否一定是液体?分散剂是否一定是液体?
[小结](三)胶体的分类
 根据分散剂的状态分
2、根据分散质的组成分
根据分散剂的状态分
2、根据分散质的组成分
气溶胶 固溶胶 液溶胶 粒子胶体 分子胶体
[讨论]举出日常生活中见到的胶体,它们分属于哪类胶体?
分散质、分散剂又各是什么物质?
[学生实验]选用下列方法、药品和仪器制备Fe(OH)3胶体,并用丁达尔现象验证之。
药品:饱和FeCl3溶液、浓NaOH溶液、蒸馏水、Fe(OH)3固体等。
仪器:烧杯、酒精灯、试管、研钵、三脚架、石棉网等
方法: A、饱和FeCl3溶液与浓NaOH 溶液混和
B、长时间煮沸饱和FeCl3溶液
C、将1-2ml饱和FeCl3溶液滴入20ml沸水中
D、将1-2mlFeCl3溶液滴入20ml 冷水中
E、将Fe(OH)3粉末研磨成直径小于10-7m的细颗粒,再分
散到极稀的FeCl3溶液中
[讨论] 上面哪些方法制得了Fe(OH)3胶体?那些不能?
|
 1、水解法 :Fe3++3H2O Fe(OH)3(胶体)+3H+
1、水解法 :Fe3++3H2O Fe(OH)3(胶体)+3H+
 2、复分解反应法:Fe3+ + 3OH- Fe(OH)3(胶体)
2、复分解反应法:Fe3+ + 3OH- Fe(OH)3(胶体)
3、固体研磨法
Ⅲ、巩固新课
[练习] 上述制取实验中,有些同学用方法C制得的Fe(OH)3胶体,产生了少量浑浊,如何除去浑浊?又如何除去里面过量的FeCl3和生成的HCl等杂质?怎样检验Fe(OH)3胶体是否净化了?
Ⅳ、结束新课
[谈话]上述制取实验中,用B法都没有得到Fe(OH)3胶体。用C法制Fe(OH)3胶体喜忧参半。大家所用的方法、药品和仪器都差不多,为什么有些成功,有些失败?其实,这些问题都涉及胶体的重要性质。欲知后事如何,且听下回分解。
Ⅴ、布置作业
[作业]课本NO.6(填表)
课外小实验:早餐时在豆浆里加白糖或加酱油,看一看有何
不同现象。
Ⅰ、引入新课
[设问]先让学生写出KI与AgNO3溶液反应的化学方程式。是否任何情况下混和AgNO3和KI溶液反应都有黄色沉淀产生呢?
 [实验]
0.01mol/1 KI
[实验]
0.01mol/1 KI
各加几滴
蒸馏水 0.01mol/L AgNO3 0.1mol/L AgNO3
① ② ③
无沉淀 无沉淀 有沉淀
[提问]上述实验中制得的液体,哪些是浊液?
[追问] ①、②号液体外观相同,都是溶液吗?它们的性质
是否完全相同?请看实验。
[实验]让一束光照射盛放①、②号液体的试管。
[小结]实验发现,②中有一条光亮的通路,这被称为丁达尔现象,
①中则无。由此可见两种液体的性质有所不同。通常我们把
②号中的液体叫胶体。本节主要介绍什么是胶体和胶体的重
要性质。
Ⅱ、讲授新课
[揭题] 第8节 胶体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com