
3、对化学实验室剩余的药品,处理方法正确的是()
A、带回家中 B、倒到指定容器中 C、随意倾倒到水槽中 D、倒回原试剂瓶中
2、以下属于物理变化的是()
A、大米酿成酒 B、菜刀生锈 C、湿衣服晾干 D、食物腐败
1、你认为下列选项不属于化学研究范畴的是()
A、物质的组成与结构 B、物质的变化与性质
C、物质的运动状态 D、物质的用途与制取
2、化学式
(1)写法:
a单质:金属、稀有气体及大多数固态非金属通常用元素符号表示它们的化学式;而氧气、氢气、氮气、氯气等非金属气体的分子由两个原子构成,其化学式表示为O2、H2、N2、Cl2 。
b化合物:正价在前,负价在后(NH3,CH4除外)
(2)意义:如化学式H2O的意义:4点 化学式 Fe的意义:3点
(3)计算:
a、计算相对分子质量=各元素的相对原子质量×原子个数之和
b、计算物质组成元素的质量比:相对原子质量×原子个数之比
c、计算物质中某元素的质量分数
1、化合价
a、写法及意义: Mg:镁元素化合价为+2价 MgCl2:氯化镁中镁元素化合价为+2价
b、几种数字的含义
Fe2+ 每个亚铁离子带两个单位正电荷 3 Fe2+:3个亚铁离子
2H2O 两个水分子, 每个水分子含有2个氢原子
c、化合物中各元素正、负化合价的代数和为零
d、化合价是元素的原子在形成化合物时表现出来的性质,所以单质分子中元素化合价为0
3、离子:带电的原子或原子团
(1)表示方法及意义:如Fe3+ :铁离子带3个单位正电荷
(2)离子结构示意图的认识
注意:与原子示意图的区别:质子数=电子数则为原子结构示意图
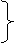

*原子数≠电子数为离子结构示意图
(3)与原子的区别与联系
|
粒子的种类 |
原 子 |
离
子 |
||
|
阳离子 |
阴离子 |
|||
|
区 别 |
粒子结构 |
质子数=电子数 |
质子数>电子数 |
质子数<电子数 |
|
粒子电性 |
不显电性 |
显正电性 |
显负电性 |
|
|
符
号 |
用元素符号表示 |
用阳离子符号表示 |
用阴离子符号表示 |
2、元素
(1)定义:具有相同核电荷数(质子数)的一类原子的总称
*一种元素与另一种元素的本质区别:质子数不同
注意:
*由同种元素组成的物质不一定是单质,(如由O2、O3组成的混合物或金刚石与石墨的混合物)不可能是化合物。
(2)表示方法--元素符号--拉丁文名称的第一个字母大写
|

|
|
|
注意:*有些元素符号还可表示一种单质 如Fe、He 、C 、Si
*在元素符号前加上数字后只能有微观意义,没有宏观意义,如3O:只表示3个氧原子
c、有关元素周期表
*发 现:门捷列夫
|
|
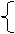
|
|
注:原子序数=质子数

d、分类
|
 组成:物质(纯净物)由元素组成
组成:物质(纯净物)由元素组成
 原子:金属、稀有气体、碳、硅等。
原子:金属、稀有气体、碳、硅等。
物质 构成 分子:如氯化氢由氯化氢分子构成。 H2、O2、N2、Cl2。
离子:NaCl等离子化合物,如氯化钠由钠离子(Na+)氯离子(Cl-)构成
 混合物(多种物质)
混合物(多种物质)
 分类 单质 :金属、非金属、稀有气体
分类 单质 :金属、非金属、稀有气体
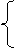 纯净物 (一种元素)
纯净物 (一种元素)
(一种物质) 化合物: 有机化合物 CH4、C2H5OH、C6H12O6、淀粉、蛋白质
 (多种元素)
氧化物
H2O CuO CO2
(多种元素)
氧化物
H2O CuO CO2
无机化合物 酸 HCl H2SO4 HNO3
碱 NaOH Ca(OH)2 KOH
盐 NaCl CuSO4 Na2CO3
第四单元 物质构成的奥秘
1、原子的构成
(1)原子结构示意图的认识
 |
 |
||||||||
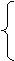 |
|||||||||
|
|||||||||
|
|||||||||
 (2)在原子中核电荷数=质子数=核外电子数
决定元素种类 质子数(核电荷数)
(2)在原子中核电荷数=质子数=核外电子数
决定元素种类 质子数(核电荷数)
(3)原子的质量主要集中在 原子核 上 (4)三决定 决定元素化学性质 最外层电子数
(4)相对原子质量≈质子数+中子数 决定原子的质量 原子核
说明:最外层电子数相同其化学性质不一定都相同(Mg,He最外层电子数为2)
最外层电子数不同其化学性质有可能相似(He,Ne均为稳定结构)
|
|
分子 |
原子 |
|
定义 |
分子是保持物质化学性质最小的微粒 |
原子是化学变化中的最小微粒。 |
|
性质 |
体积小、质量小;不断运动;有间隙 |
|
|
联系 |
分子是由原子构成的。分子、原子都是构成物质的微粒。 |
|
|
区别 |
化学变化中,分子可分,原子不可分。 |
化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
4、氢能源 三大优点无污染、放热量高、来源广
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com