
5. 在甲、乙、丙、丁四个烧杯内分别放入0.1mol的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁的质量分数大小的顺序是( )
A. 甲<乙<丙<丁 B. 丁<甲<乙=丙
C. 甲=丁<乙=丙 D. 丁<甲<乙<丙
4. 将mg含Al2O3和Fe2O3的样品溶解在过量的100mL pH=1的HCl中,然后向其中加入NaOH溶液使Fe3+,Al3+ 刚好完全转化为沉淀,用去NaOH溶液100mL,则NaOH溶液浓度为( )
A. 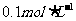 B.
B. 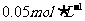
C. 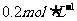 D. 无法计算
D. 无法计算
3. 经实验测得某一溶液由Mg2+,Al3+,Cl-,SO42-四种离子组成,其中Al3+,SO42-,Cl-离子的个数比为3:1:13,由此可推出该溶液中Mg2+,Al3+ 离子的个数比为( )
A. 1:3 B. 3:1 C. 1:1 D. 2:1
2. 关于氧化镁和氧化铝比较的结论中不正确的是( )
A. 都能溶于浓盐酸或浓硝酸中
B. 都能溶于氢氧化钠溶液中
C. 它们的熔点都很高,常用做耐火材料
D. 常温下都不能与水反应
1. 下列物质中,不属于合金的是( )
A. 硬铝 B. 黄铜 C. 水银 D. 钢铁
2. 铁及化合物
(1)位于元素周期表第四周期第Ⅷ族
(2)原子结构特点:
 次外层电子未达饱和,不同于主族元素次外层电子数一般为8或18、32,在化学反应中易形成阳离子:
次外层电子未达饱和,不同于主族元素次外层电子数一般为8或18、32,在化学反应中易形成阳离子: 具有可变价态。
具有可变价态。
(3)铁的性质:
① 物理性质--色、态、熔、沸点及特性
② 化学性质--与非金属单质的反应
与水反应
与酸反应
与盐溶液反应
(4)铁的氧化物及性质
(5)铁的氢氧化物及性质
(6)铁盐及亚铁盐的性质及鉴别方法
[典型例题]
[例1] 将5.1g镁、铝合金投入到500mL 2mol /L的盐酸中,金属完全溶解,再加入4mol /L的NaOH溶液,若要生成的沉淀最多,则应加入的这种NaOH溶液的体积是( )
A. 200ml B. 250mL C. 425mL D. 560mL
解析:本题考查学生对镁、铝的化学性质区别的掌握。Mg、Al与盐酸和NaOH的反应有: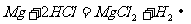 、
、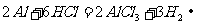 产生的两种盐分别与NaOH溶液反应:
产生的两种盐分别与NaOH溶液反应: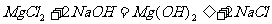 、
、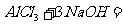
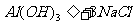 或
或 ,若使所得沉淀最多,则所加NaOH的物质的量应与盐酸的物质的量相等。即
,若使所得沉淀最多,则所加NaOH的物质的量应与盐酸的物质的量相等。即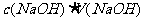
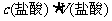
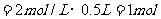
则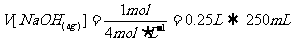
答案:B
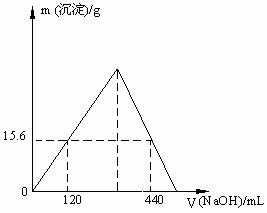
[例2] 下面是AlCl3溶液与NaOH溶液反应的三组数据及产生沉淀的质量:
① 当AlCl3溶液为440mL、NaOH溶液为120mL时,产生沉淀15.6g
② 当AlCl3溶液为120mL、NaOH溶液为440mL时,产生沉淀15.6g
③ 当AlCl3溶液为120mL、NaOH溶液为400mL时,产生沉淀31.2g
求:二溶液的物质的量浓度分别为多少mol/L?
解析:由①、②、③可知:①是NaOH溶液不足;而②是NaOH溶液过量;由①可知
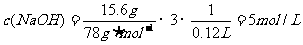
由②-③可知: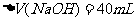 ,
,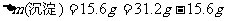
由①-②可知: ,根据图象可知:
,根据图象可知:
产生 沉淀为:
沉淀为: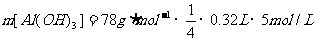
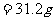
共产生沉淀: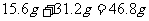
则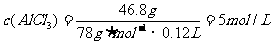
答案: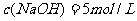
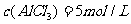
[例3] 把含有Fe2O3的铁片投入到足量的稀H2SO4中,直到铁片全部溶解。经分析,溶液中无Fe3+离子,且生成的Fe2+离子与反应产生H2的物质的量之比为10:7。原混合物中单质铁的质量分数是( )
A. 26% B. 74% C. 88% D. 95%
解析:
由题给信息可知:
1 1 1
(7mol) (7mol) 7mol
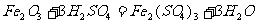
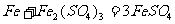
1 3
(1mol) (10-7)mol
原混合物中含单质铁为:
含Fe2O3为: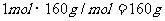
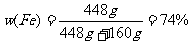
答案:B
[模拟试题](答题时间:60分钟)
1. 镁、铝及化合物
(1)Mg、Al在元素周期表中的位置及原子结构特点
(2)二者物理性质的比较
|
|
色态 |
硬度 |
 |
熔点 |
沸点 |
|
Mg |
银白色固态 |
很软 |
1.738g/cm3 |
645℃ |
1090℃ |
|
Al |
较软 |
2.70g/cm3 |
660.4℃ |
2467℃ |
(3)化学性质比较
① 与非金属单质反应
② 与水反应
③ 与酸反应
④ 与碱反应
⑤ 与氧化物反应
⑥ 与盐反应
(4)制法--电解法
(5)氧化物性质比较(类型、物理性质、化学性质)
(6)氢氧化物性质比较(类型、化学性质)
(7)盐的性质
5. 掌握铁离子的检验方法
4. 了解铁的氧化物和氢氧化物
3. 理解铁盐和亚铁盐的相互转变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com