
3.在一个暗箱里放有a个除颜色外其它完全相同的球,这a个球中红球只有3个.每次将球搅拌均匀后,任意摸出一个球记下颜色再放回暗箱.通过大量重复摸球实验后发现,摸到红球的频率稳定在25%,那么可以推算出a大约是( )
(A)12 (B)9 (C)4 (D)3
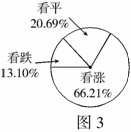 4.随着中国经济的高速发展,股市持续上涨,到2007年5月28日止,股市的开户人数已达到1亿人,同日对股民的市场抽样调查如图3所示,据此估计当日对后市看涨的股民为_________万人.
4.随着中国经济的高速发展,股市持续上涨,到2007年5月28日止,股市的开户人数已达到1亿人,同日对股民的市场抽样调查如图3所示,据此估计当日对后市看涨的股民为_________万人.
2.将五张分别画有等边三角形、平行四边形、矩形、等腰梯形、正六边形的卡片任意摆放,将有图形的一面朝下,从中任意翻开一张卡片,图形一定是中心对称图形的概率是( )
(A) (B)
(B)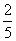 (C)
(C)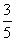 (D)
(D)
1.我市某一周的最高气温统计如下表:
|
最高气温(℃) |
25 |
26 |
27 |
28 |
|
天数 |
1 |
1 |
2 |
3 |
则这组数据的中位数与众数分别是( )
(A)27,28 (B)27.5,28
(C)28,27 (D)26.5,27
4.在具体情境中了解概率的意义;能够运用列举法(包括列表、画树状图)求简单事件发生的概率.能够准确区分确定事件与不确定事件.
3.能够对扇形统计图、列频数分布表、画频数分布直方图和频数折线图等几种统计图表进行具体运用,并会根据实际情况对统计图表进行取舍,
2.了解总体、个体、样本、平均数、加权平均数、中位数、众数、极差、方差、频数、频率等概念,并能进行有效的解答或计算.
18.(12分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:

(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是___________________
____________________________________________________________________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③___________________。
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000mol/L AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①步骤a中进行定容操作时视线应 ,
直到 。
②上述测定过程中需用溶液润洗的仪器有__________________。
③计算上述样品中CaCl2·2H2O的质量分数为______________。
④若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),某同学认为偏高的原因可能是样品中存在少量的NaCl,要验证该同学的观点应进行的实验为 (填实验名称)。
17.(21分)I.(1)分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸 ②稀硫酸 ③浓硝酸 ④稀硝酸,能随即发生剧烈反应的是(填序号,下同) ,常温下缓慢反应(或微热后能发生剧烈反应)的是 ,常温下不反应,但加热后发生剧烈反应的是 ,加热也不发生反应的是 。由此可以得到上述四种酸氧化性由强到弱的顺序是: 。
(2)工业上用洗净的废铜屑作原料来制备硝酸铜。为了节约原料和防止污染环境,宜采取的方法是 (填序号)
A.Cu + HNO3(浓)Cu(NO3)2 B.Cu + HNO3(稀)Cu(NO3)2
C.Cu空气△ CuO浓硝酸 Cu(NO3)2 D.Cu浓硫酸△ CuSO4Ba(NO3 Cu(NO3)2
(3)先将铜与浓硫酸反应产生的气体X持续通入右下图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括(可选多项,但多选倒扣分,下同)
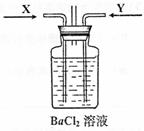 A.通入X气体后产生白色沉淀
A.通入X气体后产生白色沉淀
B.通入X气体后溶液中无明显现象
C.通入Y气体后开始沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
由此可得到的结论是:
A.HNO3的酸性比H2SO4强 B.盐酸的酸性比H2SO3强
C.BaSO3能溶于盐酸 D.HNO3能氧化H2SO3(或SO2)
E.BaSO4不溶于水也不溶于HNO3溶液
Ⅱ.下图是用过量的铜与40mL稀硝酸在100mL烧瓶中反应制取一氧化氮气体的实验装置图,请回答下列问题:

(1)反应刚开始时的现象是__________________________________________________,
反应停止时的现象是____________________________________________________,
(2)请在右框中画出气体收集装置的装置图。
(3)①从烧瓶中取出少量反应后的溶液,滴入少量氨水,写出该反应的离子方程式:
_______________________________________________________________
②反应结束后,能否采取向烧瓶中再加入稀硫酸的方式,再获得一氧化氮气体?如果可以,请写出反应的离子方程式,如果不可以,请说明理由:
_______________________________________________________________
(4)检查上图装置气密性的操作是:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com