
2、根据反应式:①2Fe3++2I-=2Fe2++I2②Br2+2Fe2+=2Fe3++2Br-可判断离子的还原性从强到弱的顺序是( )
A. Br-、Fe2+、Cl- B. I-、Fe2+ 、Br-
C.Br-、I-、Fe2+ D. Fe2+、I-、Br-
1、下列性质中,可以证明某化合物中一定存在离子键的是 ( )
A.可溶于水 B.具有较高的熔点
C.水溶液一定能够导电 D.熔融状态能够导电
28、(8分)钙是人体神经、肌肉、骨骼系统、细胞膜和毛细血管通透性的功能正常运作所必需的常量元素,维生素D参与钙和磷的代谢作用,促进其吸收并对骨质的形成和改善有重要的作用。某制药有限公司生产的“钙尔奇D600片剂”的部分文字说明如下:“本品每片含主要成分碳酸钙1.5克(相当于钙元素600毫克),成人每天服用1片。”
(1) “1.5克碳酸钙与600毫克的钙”的计量关系是如何得出来的,请列式表示
(2) 该公司的另一种产品,其主要成分与“钙尔奇D600”相同,仅仅是碳酸钙的含量不同。为测定该片剂中碳酸钙含量,某学生进行了如下的实验:取一片该片剂碾碎后放入足量的HCl中(假设该片剂的其余部分不与HCl 反应)过滤,取滤液加(NH4)2C2O4,使Ca2+ 生成CaC2O4沉淀,沉淀过滤洗涤后溶解于强酸中,并稀释成1升溶液,取其20毫升,然后用0.01摩尔/升KMnO4 溶液滴定,反应中用去6毫升KMnO4溶液,发生的离子反应为:
2MnO4― +5H2C2O4 +6H+  2Mn2+ +10CO2↑+8H2O
2Mn2+ +10CO2↑+8H2O
① 请通过计算回答该片剂中碳酸钙的含量。
② 你认为该片剂的名称应该叫“钙尔奇D________片剂”。
2009-2010届漳州三中高三化学科第二次月考卷(含答案)
可能用到的原子量:H=1 C=12 O=16 Cl=35.5 N=14 Mg=24 Ca=40 Na=23
26、(14分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为_________________________。
 (2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_____________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_____________________。
 (3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4)由②和④组成,且②和④的质量比为3∶8的化合物的电子式是 ,
该物质与⑤的同周期相邻主族元素的单质反应的化学方程式为
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为
。
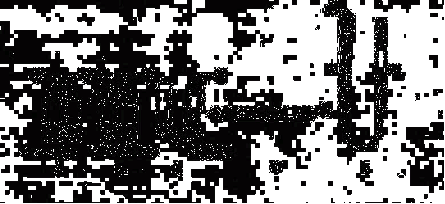 27、(10分)某课外小组模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下列仪器来制取氧气并测量氧气的体积。
27、(10分)某课外小组模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下列仪器来制取氧气并测量氧气的体积。
上图中量气装置E是由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。 甲管有刻度(0-50毫升),供量气用;乙管可上下移动,以调节液面高低。
实验室可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。试回答:
(1) 上述装置中与制取氢气所用装置原理相似的是(填各装置的字母):
(2)上述装置的连接顺序是(填各接口的编号,其中连接胶管及夹持装置均省略):
(3)装置C中放入的反应物是 和
(4)装置A的作用是
装置B的作用是
(5)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读取反应前后甲管中液面的读数、求其差值的过程中,应注意:
a.
b.
25、(13分)A、B、C、D、E均为可溶于水的固体,组成它们的离子有
|
阳离子 |
Na+ Mg2+ Al3+ Ba2+ |
|
阴离子 |
OH- Cl- CO SO SO HSO HSO |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀和气体,且沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀溶于E溶液且产生气体;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
(1)、据此推断它们是:
A ;B ;C ;D ;E 。
(2)、B溶液与过量D溶液反应的离子反应方程式________________ _
_________________________ _
24、(9分)用Cl2消毒饮用水已有百年历史,近年发现这种方法可能对人体有害。世界环保联盟推荐采用广谱高效消毒剂ClO2。ClO2是黄绿色易爆物,沸点9.90℃。制备ClO2的方法之一表述为:


 KClO3 + HCl(浓)
KCl + ClO2↑+ Cl2↑+
KClO3 + HCl(浓)
KCl + ClO2↑+ Cl2↑+

(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)
(2)盐酸在反应中显示出来的性质是_______(填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,则转移的电子的物质的量为_________mol.
(4)与传统消毒剂Cl2比较,ClO2消毒的效率(以单位质量得到的电子数表示)是Cl2的____ ___倍。
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ⅱ卷(非选择题
共54分)
22、把7.4克Na2CO3.10H2O和NaHCO3组成的固体混合物溶于水配成100mL溶液,其中(Na+)=0.6mol.L-1.若把等质量的固体混合物加热至恒温,残留固体的质量是( )
A. 3.18 g
B. 2.12g C. 4.22g D. 5.28g

2009-2010届漳州三中高三化学科第二次月考卷
21、在甲、乙、丙、丁四个烧杯中分别放入2.3g钠,6.2g氧化钠,7.8g过氧化钠和4g氢氧化钠,然后加入100g水,搅拌使固体完全溶解。则甲、乙、丙、丁溶液的质量分数大小顺序是( )
A.甲﹤乙﹤丙﹤丁 B.丁﹤甲﹤乙﹦丙
C.甲﹦丁﹤乙﹦丙 D.丁﹤甲﹤乙﹤丙
20、在电解食盐水之前,需要提纯食盐水。(1)为除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是 ( )
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸
④加过量的碳酸钠溶液 ⑤加过量的氯化钡溶液
A.①④②⑤③ B.④①②⑤③
C.②⑤④①③
D.⑤②④③①
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com