
15、[方案一] ;
(1) ;(2) 。
[方案二](1)① ;
② ;
③ ;
(2)①
;
② 。
20.(10分)平达喜是常用的中和胃酸的药物,它的化学成分是铝和镁的碱式碳酸盐,其中
氢元素的质量分数为0.040。取该碱式盐3.01g,加入2.0mol·L-1盐酸使其溶解,当
加入盐酸42.5mL时,开始产生CO2,加入盐酸至45.0mL时正好反应完全。若在上述碱
式盐溶于盐酸后的溶液中加入过量的氢氧化钠,过滤,沉淀物进行干燥后重1.74g。试
通过计算推测该碱式盐的化学式。
答案、(10分)n(CO32-)=0.005mol(2分),n(OH-)=0.08mol(2分),
n[Mg(OH)2]==0.03mol(2分),n(Al3+)=001mol(2分),
碱式盐中含有结晶水(1分),碱式盐的化学式为:Al2Mg6(OH)16CO3·4H2O(1分)。
19.(10分)某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2。为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验:
(1)在一个质量为ag的蒸发皿中加入一些样品,称得
总质量为bg。用酒精灯对其充分加热,冷却后称
得其总质量为cg。残留在蒸发皿中的固体是(填化学式)_________。
(2)另称取相同质量的样品放入锥形瓶中,实验装置如右图所示。为了保证实验成功,所选用针筒的最大刻度值应大于或等于_________(mL)。(设实验在标准状况下进行)
(3)打开活塞逐滴加入稀硫酸,至没有气泡产生为止。针筒中收集到气体折算成标准状况
下的体积为VmL(滴入稀硫酸的体积及针筒活塞的内壁的摩擦力忽略不计)。该科研小
组设称取的每份样品中的Na2CO3、NaHCO3的物质的量分别为x、y,且没有利用化学方
程式进行计算,就列出了如下算式:x+y=VmL/22400mL·mol-1,他们依据的原理是
_________。根据相似原理,请完成下列算式:2x+y=__________。由上述两算式,
该科研小组通过计算,得出了样品中的Na2CO3、NaHCO3的质量分数。
答案、(10分)(1)Na2CO3(2分)(2) (3分)
(3分)
(3)原子守恒(2分) ×2(3分)
×2(3分)
18.(12分)蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁
的实验步骤如下:
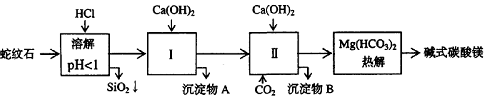
(1) 蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是________。
(2) 进行Ⅰ操作时,控制溶液pH=7~8(有关氢氧化物沉淀的pH见下表)Ca(OH)2不能过
量若Ca(OH)2过量可能会导致 溶解、 沉淀。
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
1.5 |
3.3 |
9.4 |
(3) 从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入_________ (填入物质的化学式),然后__________________________________ (依次填写实验操作名称)。
(4) 物质循环使用,能节约资源。上述实验中,可以循环使用的物质是______________(填写物质化学式)。
(5) 现设计一个实验,确定产品aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):①样品称量 ②高温分解 ③
__________________________④_____________________________ ⑤MgO称量
(6) 18.2g产品完全分解后,产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中:
a=_________、b=_________、c=_________。
答案、(12分)(1)Fe3+ Al3+;(2)Al(OH) 3、Mg(OH)2;(3)NaOH,过滤、洗涤、灼烧;
 ( 4)CO2;(5)③测出CO2的质量;④测出水蒸汽的质量;(6)3、1、3。
( 4)CO2;(5)③测出CO2的质量;④测出水蒸汽的质量;(6)3、1、3。
17.(12分);图中字母所代表的物质均为中学化学常见物质。其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料;常温下C、D、H为气体单质。单质E、M、N为金属,N是地壳中含量最大的金属元素。Y是红褐色沉淀。这些物质在一定条件下存在如下转化 关系,其中有些反应物或生成物已经略去。试回答下列问题:

(1) 工业上,在电解A溶液的设备中将阴极区和阳极区用 隔开。
(2) Z→L反应的名称是 ,K的电子式为 。
(3) 写出B→F的离子方程式 。
(4) 写出K与CO2反应的化学方程式 。
(5) Y与NaClO和B混合溶液作用,是制备绿色水处理剂(Na2MO4)的一种方法,请写出有关反应的离子方程式
。
答案、(12分) (1)阳离子交换膜(2分);
(2)(4分);铝热反应, 
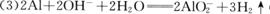 (2分);
(2分);
 (2分);
(2分);
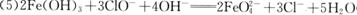 (2分);
(2分);
16.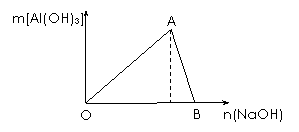 (10分)图为一定量AlCl3溶液中加入NaOH溶
(10分)图为一定量AlCl3溶液中加入NaOH溶
液后,产生Al(OH)3白色沉淀的质量与NaOH的
物质的量之间的关系曲线。试回答:
(1) A点时已参加反应的AlCl3和 NaOH的物质的
量之比为1比 。
(2) OA段曲线所表示的反应的离子方程式是
___________________。AB段曲线所表示的反应的离子方程式是
______________________________________________________________。
(3) B处溶液中存在的浓度最大的离子是 (填离子符号)。向B处生成的溶液中通
入二氧化碳,可见到的现象是 。
(4) 向含有0.1mol NH4Al(SO4)2溶液中逐 滴加入5mol·L-1NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;
 一段时间后有有刺激性气味的气体
一段时间后有有刺激性气味的气体
逸出;最后白色沉淀逐渐减少并最终消
失。请在右图中画出生成沉淀的物质的
量与加入NaOH溶液体积的关系示意
图。
答案、(10分)(1) 3(1分);
(2) Al3++3OH-=Al(OH)3↓(2分);Al(OH)3+OH-=AlO2-+2H2O(2分);
(3) Na+(1分);生成白色沉淀(1分)。
 (4) (3分)
(4) (3分)
15.(18分)铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
[方案一]
[实验方案]将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是 。
[实验步骤]
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(填“偏高”、“偏低”或“无影响”)。
[方案二]
[实验方案]将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01 105Pa)的体积。
105Pa)的体积。
[问题讨论]
(1)同学们拟选用下列实验装置完成实验:


①你认为最简易的装置其连接顺序是:A接( )( )接( )( )接( )(填接口字母,可不填满。)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因 。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是 。
A.待实验装置冷却后再读数
 B.上下移动量筒F,使其中液面与广口瓶中液面相平
B.上下移动量筒F,使其中液面与广口瓶中液面相平
C.上下移动量筒G,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:
稀硫酸 滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,
使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有
少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实
验装置。
①装置中导管a的作用是
。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_______mL。
答案、(18分)
[方案一]2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2分)(1)97mL(2分)(2)偏高(1分)
[方案二](1)①EDG(2分)
②锌与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大(2分)③ACD(3分)
(2)①使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差。(4分) ②V1-V2 (2分)
14.在Al2(SO4)3、K2SO4和明矾的混和溶液中,如果c(SO42-)等于0.2mol/L,当加入等体积的0.2mol/L的KOH溶液时,生成的沉淀恰好溶解,则原和物中K+的物质的浓度为(B )
A.0.2mol/L B.0.25mol/L C.0.45mol/L D.0.225mol/L
13.将质量为w1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标
准状况下的气体V1L。向溶液中逐滴加入浓度为amol·L-1的HCl溶液,过程中有白色沉淀生
成后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2L。将溶液蒸干灼烧得固体w2g。
下列关系式中不正确的是(A )
A.35.5aV2=w2-w1 B.23n(Na)+27n(Al)=w1
C.n(Na)+3n(Al)=2V1/22.4 D.58.5n(Na)+51n(Al)=w2
12.向1.00 L0.3mol / L 的NaOH 溶液中缓慢通入0.2molCO2气体,使其完全反应,对反应后的溶液,下列判断正确的是( BD)
A.溶质只有Na2CO3 B.c(HCO3-)>c(CO32-)
C.c(OH-)>c(HCO3-) D.c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com