
3.(理)函数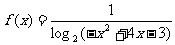 的定义域为 ( )
的定义域为 ( )
A.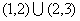 B.
B.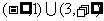
C.(1,3) D.[1,3]
(文)函数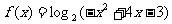 的定义域为 ( )
的定义域为 ( )
A.(1,3) B.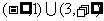
C.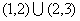 D.[1,3]
D.[1,3]
2.函数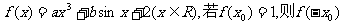 的值为 ( )
的值为 ( )
A.3 B.0 C.-1 D.-2
1.(理)已知全集U=R,集合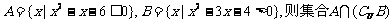 等于 ( )
等于 ( )
A.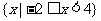 B.
B.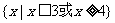
C.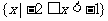 D.
D.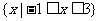
(文)已知集合 等于( )
等于( )
A.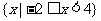 B.
B.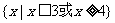
C.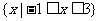 D.
D.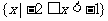
28.下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 10.00%的K2SO4溶液、足量的CuSO4溶液、100mL AlCl3和Cu(NO3)2的混合溶液,乙中其中一个电极为锌电极,其余均为石墨电极。一段时间后,e电极质量增加。理论上丙中两极所得气体的体积随时间变化的关系如下图所示(气体体积已换算成标准状况下的体积)。据此回答下列问题:
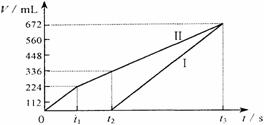
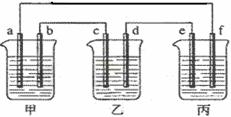
(1)a为 极,d的电极材料为 。(2分)
(2)电极b的电极反应式为 ,t3时甲中溶液的质量分数为 。(4分)
(3)原混合溶液中Cu(NO3)2的物质的量浓度是 。(2分)
(4)丙溶液在t2-t3时间内,pH值的变化情况为 (填“增大”“减小”或“不变”),此段时间内发生反应的方程式为 。(2分)
(5)计算:①t2时所得溶液的pH;②电解至t3时,丙中消耗水的质量。(6分)
27.A、B、C、D、E、F、G、H是元素周期表中前四个周期的八种元素。已知A、C、E、G、H的基态原子中未成对电子数与其所在的周期序数相同,B与H同族,D、H、F 同一周期且原子序数依次增大,A与B的原子核外电子数之和与C原子的核外电子数相等且A、B、C能形成离子化合物,D原子的电子层数与价电子数相等但只有1个未成对电子,E的价电子数是G 的两倍,F原子的最外层也只有1个未成对电子。
(1)B、C、D、H四种元素的第一电离能由大到小的顺序为_____________________,电负性由小到大的顺序为____________________,B、F、G、H的最高价氧化物的水化物的酸性由强到弱的顺序为___________________________________(用化学式表示)。(3分)
(2)A、B、C形成的此化合物受热时发生反应的类型为__________(填序号)。(2分)
A.化合反应 B.分解反应 C.置换反应 D.氧化还原反应
(3)等质量的D的单质分别与足量的盐酸和氢氧化钠溶液反应放出的气体在常温常压下的体积比为__________,将所得溶液混合时含有D元素的两种物质间发生反应的离子方程式为___________________________________________________。(4分)
(4)G的最高价含氧酸的钠盐中属于酸式盐的一种的水溶液显________性,其原因是____________________________________________________________(用必要的离子方程式和文字说明),溶液中离子浓度大小的顺序为______________________。(5分)
(5)将E 与G的单质用导线连接同时插入氯化钠溶液中构
 成的原电池的总反应为___________________________
成的原电池的总反应为___________________________
__________。E单质在常温下遇到A、B、C形成的另一
化合物的浓溶液发生钝化现象,请写出过量的E 单质在
此化合物的稀溶液中发生反应的离子方程式__________
_____________________。E3+与E2+的稳定性大小为____
______,E3+的基态电子排布式为_______________,在右
图的方框内画出E的基态原子的轨道表示式。(8分)
26.现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
 Ⅰ.实验步骤:
Ⅰ.实验步骤:
(1)用_____________________(填仪器名称,下同)量取10.00mL食用白
醋,在_________中用水稀释后转移到100mL___________中定容,摇匀
即得待测白醋溶液。(3分)
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,并滴加2滴
作指示剂。(1分)
(3)读取盛装0.1000 mol/L NaOH 溶液的碱式滴定管的初始读数。如果液
面位置如右图所示,则此时的读数为 。(1分)
(4)滴定:当 时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。(2分)
Ⅱ.实验记录:
|
滴定次数 |
1 |
2 |
3 |
4 |
|
V(样品)(mL) |
20.00 |
20.00 |
20.00 |
20.00 |
|
V(NaOH)(消耗)(mL) |
15.95 |
15.00 |
15.05 |
14.95 |
Ⅲ.数据处理与讨论:
(1)计算可得c(市售白醋) = ,市售白醋总酸量= g/100mL。(2分)
(2)某同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想确定醋酸与苯甲酸钠是否发生反应,需查找在一定温度下的 (填序号)。(1分)
A.pH B.电离度 C.电离常数 D.溶解度
(3)在本实验的滴定过程中,下列操作会使实验结果偏大的是 (填序号)。(2分)
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.锥形瓶在滴定时剧烈摇动,有少量液体溅出
25.下表是五种元素的电离能数据(单位:kJ/mol),最可能处于同一族的是 ( )
A.R和U B.Q和R C.T和U
D.R和T E.S和T
|
元素代号 |
I1 |
I2 |
I3 |
I4 |
|
Q |
2080 |
4000 |
6100 |
9400 |
|
R |
500 |
4600 |
6900 |
9500 |
|
S |
740 |
1500 |
7700 |
10500 |
|
T |
580 |
1800 |
2700 |
11600 |
|
U |
420 |
3100 |
4400 |
5900 |
24.已知短周期元素的离子aA2+、bB+、cC3-、dD2-都具有相同的电子层结构,则下列叙述正确的是 ( )
①原子半径A>B>D>C ②原子序数c<d<b<a ③离子半径C>D>B>A
④单质的还原性A>B>D>C ⑤第一电离能B<A<C<D ⑥电负性B<A<C<D
A.①④⑥ B.②③⑤ C.②③⑥ D.③⑤⑥
23.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.2mol Cu2 (OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中共转移的电子数为 ( )
A.1.2mol B.0.8mol C.1.0mol D.1.6mol
22.在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系不正确的是( )
 A.c(HCO3-)>c(ClO-)>c(OH-)
A.c(HCO3-)>c(ClO-)>c(OH-)
B.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)
 C.c(HCO3-)>c(OH-)>c(H+)
C.c(HCO3-)>c(OH-)>c(H+) 
D.c(Na+)=2c(HCO3-)+2c(H2CO3)+2c(CO32-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com