
3.甲、乙两个质量相等的物体,以相同的初速度在粗糙程度不同的水平面上运动,甲物体先停下,乙物体后停下,则
A.甲物体受到的冲量大 B.两物体受到的冲量等大
C.两物体的位移相同 D.阻力对乙物体做的功更多
2.2009年2月11日俄罗斯的“宇宙-2251”和美国的“Iridium 33”卫星在西伯利亚上空约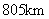 处发生碰撞,产生大量碎片。据太空专家分析,部分碎片因受阻力作用运动半径开始逐渐变小,则这些碎片的
处发生碰撞,产生大量碎片。据太空专家分析,部分碎片因受阻力作用运动半径开始逐渐变小,则这些碎片的
 A.运动周期变大 B.线速度变大
A.运动周期变大 B.线速度变大  C.加速度变小
D.机械能变大
C.加速度变小
D.机械能变大
1. 关于地球同步卫星,下列说法正确的是
A. 卫星可以经过地球两极的上方 B. 卫星质量越大,绕地球运行的速度就越大
C. 卫星的速度大于第一宇宙速度 D. 卫星绕地球运动的周期等于地球自转周期
36.(18分)如图所示物块A、B质量分别为2kg、1kg,两物块与皮带之间的动摩擦因数
μ=0.5,中间夹有一长度很小、劲度系数很大的弹簧,弹簧与两物块均不相连,弹簧处于压缩状态并被锁定。初始时刻,用手将A、B按住,此时B物块与皮带上端点P点相距L1=1.8m,A物块与皮带下端点Q点相距L2=8.35m,两物块都可以看作质点,皮带轮的半径r=0.2m。现使皮带轮以角速度ω=30rad/s开始逆时针转动起来,与此同时,放开按着两物块的手,弹簧解除锁定并将两物块在极短时间内弹开,弹簧长度改变量很小。若B物块到达P端时速度刚好减到零,皮带轮与皮带间不打滑,重力加速度g取10m/s2,θ=37o,cos37o=0.8。求:
(1)皮带的速度v0的大小;
(2)弹簧弹开过程中释放的弹性势能;
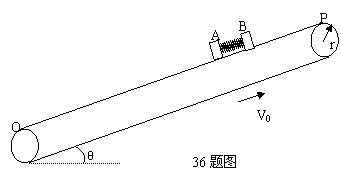 (3)A物块从开始被弹开到Q端所用的时间。
(3)A物块从开始被弹开到Q端所用的时间。





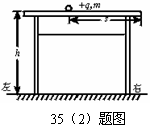
35.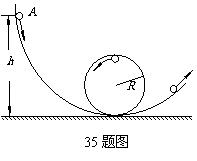 (1)(9分)如图是离心轨道演示仪结构示意图。光滑弧形轨道下端与半径为R的光滑圆轨道相接,整个轨道位于竖直平面内。质量为m的小球从弧形轨道上的A点由静止滑下,进入圆轨道后沿圆轨道运动,最后离开圆轨道。小球运动到圆轨道的最高点时,对轨道的压力恰好与它所受到的重力大小相等。重力加速度为g,不计空气阻力。求:
(1)(9分)如图是离心轨道演示仪结构示意图。光滑弧形轨道下端与半径为R的光滑圆轨道相接,整个轨道位于竖直平面内。质量为m的小球从弧形轨道上的A点由静止滑下,进入圆轨道后沿圆轨道运动,最后离开圆轨道。小球运动到圆轨道的最高点时,对轨道的压力恰好与它所受到的重力大小相等。重力加速度为g,不计空气阻力。求:
(1)小球运动到圆轨道的最高点时速度的大小;
(2)小球开始下滑的初始位置A点距水平面的竖直高度h。
(2).在一高为h=0.8m的绝缘光滑水平桌面上,有一个带电量为+q、质量为m的带电小球静止,小球到桌子右边缘的距离为s=0.4m,突然在整个空间中施加一个水平向右的匀强电场E,且qE= 2 mg,如图18所示,求:
 (1)小球经多长时间落地?
(1)小球经多长时间落地?
(2)小球落地时的速度.
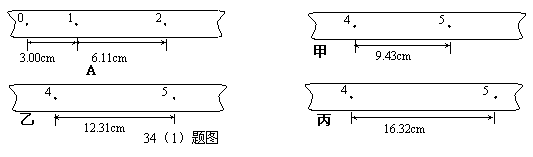
34.(1)(9分) 某同学在测定匀变速直线运动的加速度时,得到了在不同拉力下的A、B、C、D……等几条较为理想的纸带,并在纸带上每5个点取一个计数点,即相邻两计数点间的时间间隔为0.1s,将每条纸带上的计数点都记为0、1、2、3、4、5……,如图所示甲、乙、丙三段纸带,分别是从三条不同纸带上撕下的.
根据已有的数据,计算打A纸带时,物体的加速度大小是 m/s2;打下1点时的速度大小 m/s ; 在甲、乙、丙三段纸带中,属于纸带A的是 .

(2)(9分)如图所示装置可用来验证机械能守恒定律,摆锤A拴在长为L的轻绳一端,另一端固定在O点,在A上放一个小铁片,现将摆锤拉起,使绳偏离竖直方向θ角,由静止开始释放摆锤,当其到达最低位置时,受到竖直档板P阻挡而停止运动,这时铁片将做平抛运动而飞离摆锤,用刻度尺量出铁片的水平位移为S,下落高度为H。
①要验证摆锤在运动中机械能守恒,必须求出摆锤初始位置离最低点的高度,其高度为 ,同时还应求出摆锤在最低点时的速度,其速度应为 。
②用实验中测量的物理量写出明摆锤在运动中机械能守恒的关系式为 。
33、(18分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。

根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是: ;
(2)PCl5分解成PCl3和Cl2的热化学方程式是: ;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率 1等于
;若反应温度由T1升高到T2,平衡时PCl5的分解率为
1等于
;若反应温度由T1升高到T2,平衡时PCl5的分解率为 2,
2,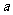 2
2
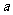 1(填“大于”、“小于”或“等于”);
1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,现将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是 ;
(4)P和Cl2分两步反应生成1 mol PCl5的△H 3= ,P和Cl2一步反应生成1 mol PCl5的△H 4 △H 3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是: 。
32、(16分)化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成。
I.制备:

⑴结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是:__________________。
⑵操作Ⅲ的名称是____________________。
Ⅱ.组成测定:称取一定质量实验所得晶体置于锥形瓶中,加足量蒸馏水和稀H2SO4.将C2O42-完全转化为H2C2O4,用0.10mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液24.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00mL。相关反应如下:2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2↑ + 8H2O
MnO4- + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O
⑶配制l00mL 0.10mol·L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有 和 (写名称)。两个滴定中到达终点时溶液颜色为
色,且30秒内不变色。
⑷通过计算,该化合物KxFe(C2O4)y·3H2O中的x= 。
31、(14分)已知X、Y、Z、W四种元素是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的核外电子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:(1)X、Z二种元素的元素符号:X_________;Z__________
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为______、_____、_____
(3)由X、Y、Z所形成的常见离子化合物是___________,它与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式__________
 (4)在由X、Y、Z、W四种元素形成的常见化合物或单质中,不能形成的晶体类型是________
(4)在由X、Y、Z、W四种元素形成的常见化合物或单质中,不能形成的晶体类型是________
30、(16分)(1)元素周期表是20世纪科学技术发展的重要理论依据之一,是我们学习化学的重要工具。假设NH4+是“元素”NH4的阳离子,则“元素” NH4在周期表中的位置应该是第 周期第 族;“元素” NH4的单质常温常压下应为 (填“固”、“液”或“气”)体;熔点 (填“高”或“低”) ; (填“能”或“不能”)导电;NH4的碳酸盐应 (填“易”或“不易”)溶于水。
(2)氯、溴、碘同属于周期表中的VII A族,在上个世纪,人们很早就制得高碘酸及其盐,但得不到含+7价溴的化合物,1968年,化学家用发现不久的XeF2和KBrO3首先制得纯净的KBrO4晶体。
①高碘酸盐(IO65-)能在酸性条件下将Mn2+氧化为MnO4-(本身被还原成I03-),其反应平稳而迅速,写出离子反应方程式: 。
②在25℃,已知pH=2的高碘酸溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01mol·L-1的碘酸或高锰酸溶液与pH=12的NaOH溶液等体积混合,所得混合液显中性。则高碘酸是 ;高锰酸是 (填“强酸”或“弱酸”)。
③写出XeF2和含KOH、KBrO3的水溶液反应得到KBrO4的离子方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com