
16、能正确表示下列反应的离子方程式是 ( )
A.饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液 Ca2+ + HCO3- + OH- = CaCO3↓+ H2O
B.氯化亚铁溶液中加入硝酸 Fe2+ + 4H+ + NO3- = Fe3+ + 2H2O + NO↑
C.在硫酸铜溶液中加入过量氢氧化钡溶液: Ba2++SO42-=BaSO4↓
D.AlCl3溶液中加入足量的氨水: Al3++ 3OH-===Al(OH)3↓
第Ⅱ卷(非选择题,共52分)
15、某Y形河流上游有甲、乙两个化工厂,其位置如图所示。现已知甲、乙两个工厂排入河流
的废水中共有K+、Ag+、Fe3+、C1-、OH-、NO3-6种离子,则在河流下游丙处的水中至少含有离子
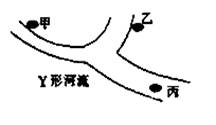 (不考虑水电离出的离子)
(不考虑水电离出的离子)
A.2种
B.3种
C.4种
D.6种
14、钢铁“发蓝”的一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到
130℃反应。其过程可以用如下方程式表示:
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑ ②6Na2FeO2+NaNO2+5H2O=3 Na2Fe2O4+ NH3↑+7NaOH
③Na2FeO2+ Na2Fe2O4+2H2O=Fe3O4+4NaOH 下列说法正确的是( )
A.反应①②③均为氧化还原反应
B.该生产过程符合绿色化学思想
C.整个反应过程中,每有5.6gFe参加反应转移0.3 mol电子
D.反应①②中的氧化剂均为NaNO2
13、“绿色试剂”双氧水可作为矿业废液消毒剂。利用双氧水可除去矿业废液中的氰化物,反应的化学方程式为KCN+H2O2+H2O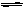 X+NH3↑(X为一种化合物,化学方程式已配平)。下列有关说法不正确的是:( )
X+NH3↑(X为一种化合物,化学方程式已配平)。下列有关说法不正确的是:( )
A、X的化学式为KHCO3 B、反应中KCN作还原剂
C、生成1molX时转移了2mol电子 D、X属于共价化合物
12、某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验( )
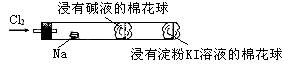
实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟。以下叙述错误的是
A.钠着火燃烧产生苍白色火焰
B.反应生成的大量白烟是氯化钠晶体
C.管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气
D.管右端棉球外颜色变化可判断氯气是否被碱液完全吸收
11、在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是 ( )
A.加入有色布条,一会儿有色布条褪色,说明溶液中有C12存在
B.溶液呈黄绿色,且有刺激性气味,说明有C12分子存在
C.先加入盐酸酸化,再加入AgNO3溶液产生白色沉淀,说明有C1–存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HC1O分子存在
10、对于某些离子的检验及结论一定正确的是
A.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,则原溶液中有NH4+
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定有SO42¯
C.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中一定有CO32¯
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
9、一定能在下列溶液中大量共存的离子组是
A.水电离产生的H+浓度为1×10-12mol·L-1的溶液:NH4+、Na+、Cl-、HCO3-
B.含有大量Fe3+的溶液:SCN-、I-、K+、Br-
C.能使pH试纸变蓝色的溶液:Na+、[Al(OH)4]-、S2-、CO32-
D.澄清透明的无色溶液:ClO-、MnO4-、Al3+、SO42-
8、NA表示阿伏加德罗常数。下列说法中不正确的是
A.2.3 g Na和足量的O2完全反应,在常温和燃烧时,转移电子均为0.1NA
B.28.6g Na2CO3·10H2O在溶液中,含有的CO32-离子小于0.1NA
C.1.6g的O2 或O2和O3的混合气体中,含有的氧原子数均为0.1NA
D.标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移电子均为0.1NA
7、下列溶液中的c(Cl-)与50mL 1mol·L-1氯化铝溶液中的c(Cl-)相等的是:
A.150mL 1mol·L-1氯化钠溶液 B.75 mL 2mol·L-1氯化铵溶液
C.150 mL 3mol·L-1氯化钾溶液 D.50 mL 1mol·L-1氯化亚铁溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com